Слайд 5
Первые математические алгоритмы для КТ были разработаны в 1917
году австрийским математиком Радоном (преобразование Радона)
В 1963 году американский физик
Кормак повторно (но отличным от Радона способом) решил задачу томографического восстановления, а в 1969 году британский инженер-физик Хаунсфилд из фирмы “EMI LTD”сконструировал «ЭМИ-сканер» (EMI-scanner) — первый компьютерный рентгеновский томограф, клинические испытания которого прошли в 1971 году, разработанный только для сканирования головы.
Средства на разработку КТ были выделены фирмой EMI, в частности, благодаря высоким доходам, полученным от контракта с группой The Beatles.
В 1979 году «за разработку компьютерной томографии» Кормак и Хаунсфилд были удостоены Нобелевской премии по физиологии и медицине.
Краткая история метода
Слайд 6
где q(l, θ) − функция поглощения;
L(l, θ) -
некоторый луч зрения;
с(х, у) - плотность вещества на
луче зрения.
Слайд 7
Аппарат 1-го поколения появился в 1973 году. Была одна

трубка, направленная на один детектор. Сканирование производилось шаг за
шагом, делая по одному обороту на слой. Каждый слой обрабатывался около 4 минут.
Во 2-м поколении КТ-аппаратов использовался веерный тип конструкции. На кольце вращения напротив рентгеновской трубки устанавливалось несколько детекторов. Время обработки изображения составило 20 секунд.
3-е поколение компьютерных томографов ввело понятие спиральной компьютерной томографии. Трубка и детекторы за один шаг стола синхронно осуществляли полное вращение по часовой стрелке, что значительно уменьшило время исследования. Увеличилось и количество детекторов. Время обработки и реконструкций заметно уменьшилось.
4-е поколение имеет 1088 люминесцентных датчиков, расположенных по всему кольцу. Вращается лишь рентгеновская трубка. Благодаря этому методу время вращения сократилось до 0,7 секунд. Но существенного отличия в качестве изображений с КТ-аппаратами 3-го поколения не имеет.
Основы работы
Слайд 8
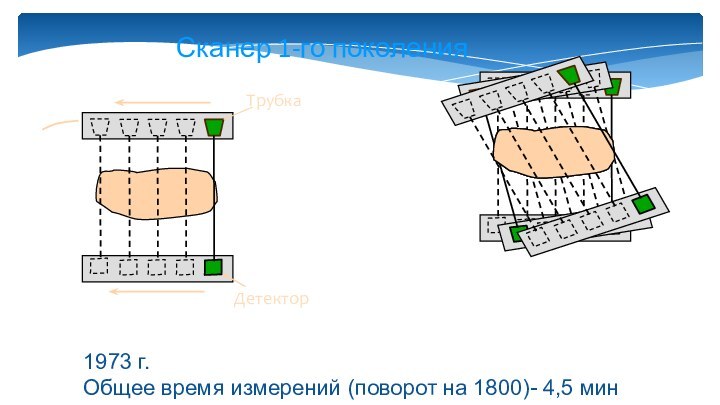
Сканер 1-го поколения
1973 г.
Общее время измерений (поворот на
1800)- 4,5 мин
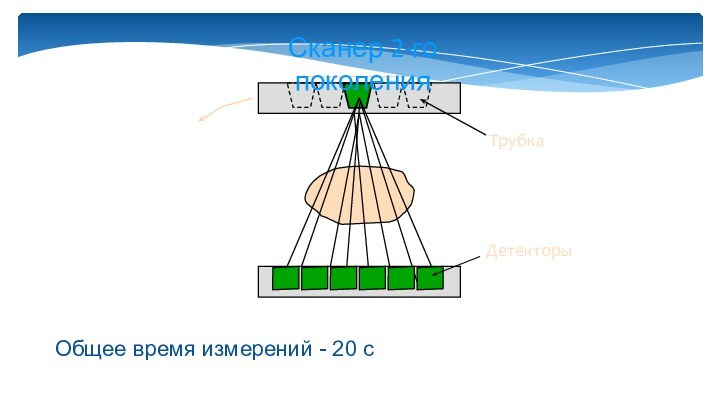
Слайд 9
Трубка
Детекторы
Сканер 2-го поколения
Общее время измерений - 20 с
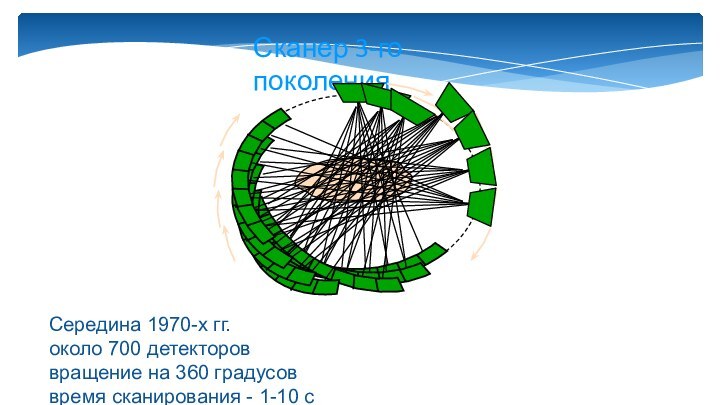
Слайд 10
Сканер 3-го поколения
Середина 1970-х гг.
около 700 детекторов
вращение на
360 градусов
время сканирования - 1-10 с
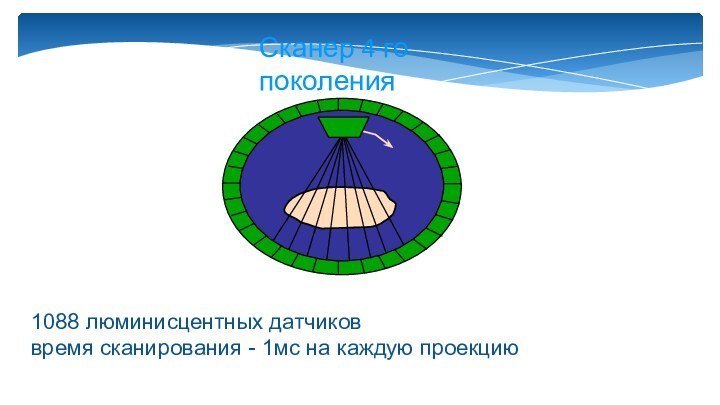
Слайд 11
Сканер 4-го поколения
1088 люминисцентных датчиков
время сканирования - 1мс
на каждую проекцию
Слайд 12
Томографический эффект можно получить при следующих комбинациях:
неподвижный объект
и движущиеся источник (рентгеновская трубка) и приемник (рентгенографическая пленка,
селеновая пластина, кристаллический детектор и т.п.);
неподвижный источник излучения и движущиеся объект и приемник излучения
неподвижный приемник излучения и движущиеся объект и источник излучения
Слайд 13
В системе сбора данных ток от каждого детектора
(500-2400 шт.) преобразуется в цифровой сигнал и после усиления
подается на компьютер для обработки и хранения. Только после этого начинается процесс восстановления изображения.
Восстановление изображения среза по сумме собранных проекций является чрезвычайно сложным процессом, и конечный результат представляет собой некую матрицу с относительными числами, соответствующую уровню поглощения каждой точки в отдельности.
В компьютерных томографах применяются матрицы первичного изображения 256х256, 320х320, 512х512 и 1024х1024 элементов.
Слайд 14
Для получения более четкого изображения патологически измененных зон
в головном мозге используют эффект усиления контрастности, который осуществляется
внутривенным введением рентгеноконтрастного вещества.
Увеличение плотности изображения на компьютерной томограмме после внутривенного введения контрастного вещества объясняется внутри- и внесосудистыми компонентами. Внутрисосудистое усиление находится в прямой зависимости от содержания йода в циркулирующей крови.
Нормальное увеличение плотности мозга на компьютерной томограмме после введения контрастного вещества связано с внутрисосудистой концентрацией йода. Можно получить изображение сосудов диаметром до 1,5 мм, если уровень йода в крови составляет примерно 4 мг/мл и при условии, что сосуд расположен перпендикулярно к плоскости среза. Наблюдения привели к выводу, что контрастное вещество накапливается в опухолях.
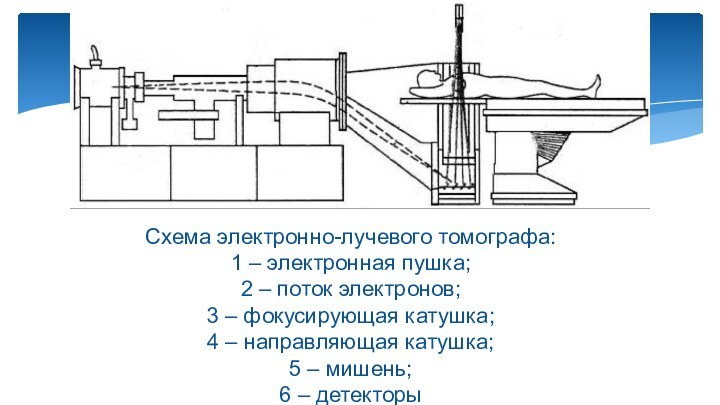
Слайд 15
Схема электронно-лучевого томографа:
1 – электронная пушка;
2
– поток электронов;
3 – фокусирующая катушка;
4 – направляющая
катушка;
5 – мишень;
6 – детекторы
Слайд 16
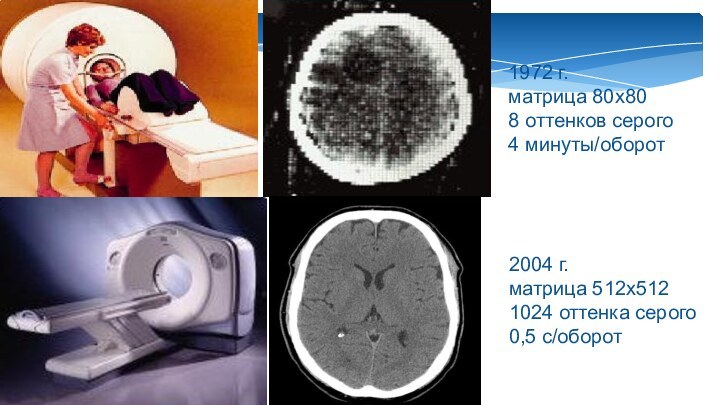
1972 г.
матрица 80х80
8 оттенков серого
4 минуты/оборот
2004 г.
матрица 512х512
1024
оттенка серого
0,5 с/оборот
Слайд 18
Исследование основания черепа;
Исследование внутричерепных гематом и травм черепа;
Исследования
последствий травм мозга;
Исследование опухолей и нарушения кровообращения в мозгу;
Поражения
костей черепа, пазух, желез;
Определение поражений сосудов атеросклерозом и аневризмой;
В каких случаях выполнять?
Слайд 22
Отличие МСКТ от обычной компьютерной томографии состоит в
применяемом оборудовании, в его возможностях.
В МСКТ особенность томографов
последних разработок, заключается в том, что один поток рентгеновских лучей улавливается сразу несколькими рядами детекторов.
Такие томографы за одно вращение сканируют весь орган. Это разрешает получить сразу несколько сотен срезов, увеличивается четкость снимков, а также сокращается время сканирования, что снижает лучевую нагрузку.
Доза облучения пациента снижена в три раза по сравнению в отличие от КТ.
Слайд 24
Годом основания магнитно-резонансной томографии принято считать 1973 г.,
когда профессор химии Пол Лотербур опубликовал в журнале Nature статью «Создание
изображения с помощью индуцированного локального взаимодействия; примеры на основе магнитного резонанса». Позже Питер Мэнсфилд усовершенствовал математические алгоритмы получения изображения. За изобретение метода МРТ оба исследователя в 2003 году получили Нобелевскую премию по медицине.
Однако имеются сведения о том, что В. А. Иванов в 1960 году направил в Госкомитет СССР по делам изобретений и открытий по делам изобретений заявку на патент «Способ определения внутреннего строения материальных тел» за номером 0659411/26 (включая методику и устройство прибора), в которой были сформулированы принципы метода МРТ и приведена схема томографа.
За изобретение метода МРТ Питер Мэнсфилд и Пол Лотербур получили в 2003 году Нобелевскую премию в области медицины.
ИСТОРИЯ
Слайд 26
Достоинства МРТ
Неинвазивность
Отсутствие ионизирующего излучения
Трехмерный характер получения изображений
Высокий мягкотканый
контраст
Естественный контраст от движущейся крови
Высокая диагностическая эффективность
Слайд 27
Компоненты МР томографа
Магнит – создает статическое однородное магнитное
поле
Градиентные катушки – слабое переменное магнитное поле
Радиочастотные катушки –
передают радиочастотный импульс и принимают МР сигнал
Компьютер – управление томографом, получение и обработка МР сигнала, реконструкция МР изображений
Слайд 28
Принцип МРТ
Помещение пациента в статическое магнитное поле
- протоны
ориентируются вдоль магнитного поля
Добавление переменного поля для выбора среза
в теле пациента
Передача РЧ импульса
- энергия импульса передается протонам
Протоны отдают полученную энергию
- в приемных катушках индуцируется электрический ток
МР сигнал преобразуется компьютером и используется для построения изображений
Слайд 29
Медицинское оборудование и устройства
Ферромагнитные аневризматические клипсы (Drake, Heifetz,
Kapp, Mayfield, Sundt-Kees)
Многие водители ритма (Cosmos II, Delta TRS,
KAPPA DR706, Nova Model)
Стент Zenith AAA Endovascular Graft - Cook, Inc.
Инсулиновые насосы (Cozmo Insulin Pump, MiniMed Insulin Pump, Stryker PainPump 2)
Некоторые экспандеры для молочных желез (Style 133 with MAGNA-SITE Injection Site magnetic port - McGhan Medical/INAMED Aesthetics, )
Слайд 30
Радиочастотные катушки
Коленная катушка
Головная катушка
Нейроваскулярная катушка
Существуют РЧ-катушки для исследования
головного мозга, позвоночника, сосудов шеи, молочных желез, коленного сустава,
плечевого сустава и многие другие.
При покупке МР-томографа его комплектование набором РЧ-катушек осуществляется в соответствии с потребностями конкретного лечебного учреждения, поэтому большинство отделений МРТ не обладает возможностью проведения полного спектра МР-обследований.
Слайд 32
Время спин-решеточной релаксации (Т1), время спин-спиновой релаксации (Т2)
являются свойствами спинов тканей.
Значения этих величин меняются от
одной нормальной ткани к другой и от одной больной ткани к другой. Поэтому они создают контрастность между тканями в различных типах изображений
Слайд 33
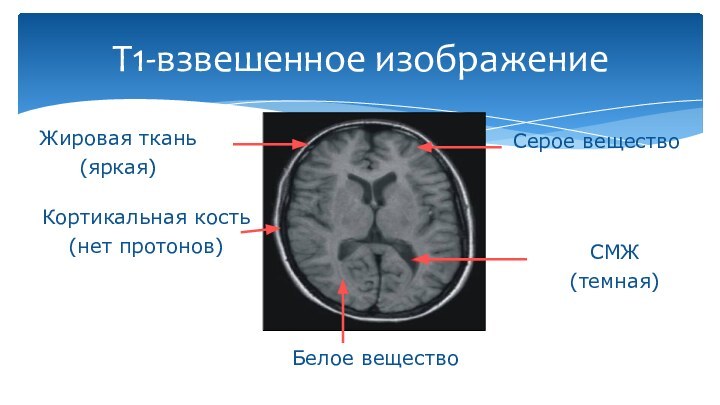
Т1-взвешенное изображение
Жировая ткань
(яркая)
СМЖ
(темная)
Кортикальная кость
(нет протонов)
Серое вещество
Белое вещество
Слайд 34
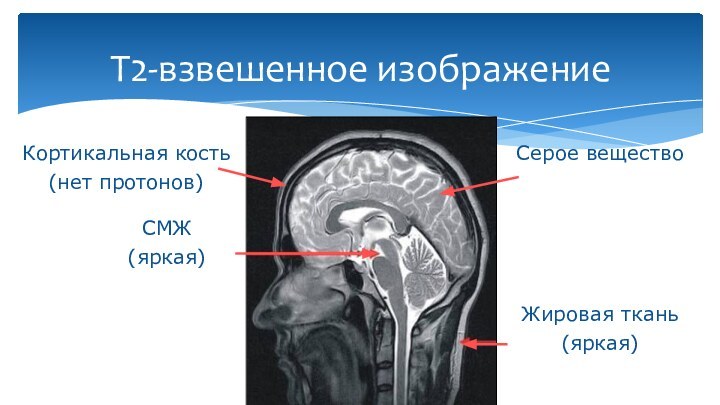
Т2-взвешенное изображение
СМЖ
(яркая)
Жировая ткань
(яркая)
Кортикальная кость
(нет протонов)
Серое вещество
Слайд 35
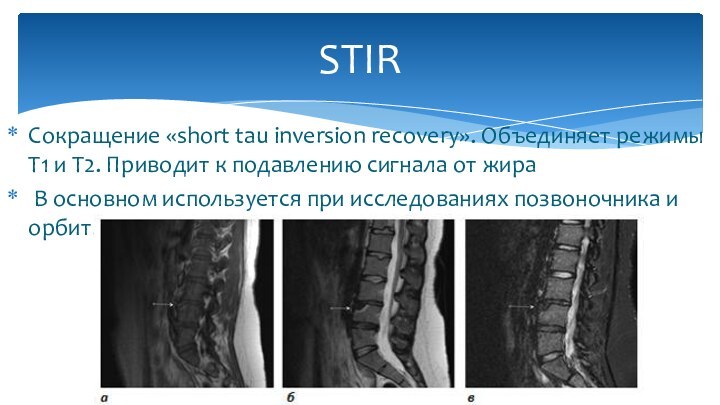
Сокращение «short tau inversion recovery». Объединяет режимы Т1
и Т2. Приводит к подавлению сигнала от жира
В
основном используется при исследованиях позвоночника и орбит.
STIR
Слайд 36
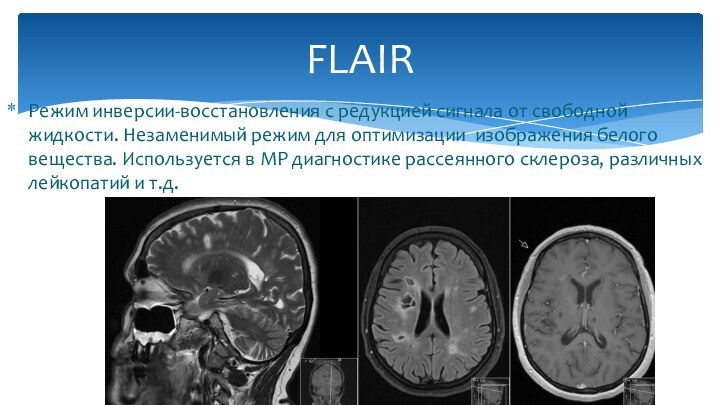
Режим инверсии-восстановления с редукцией сигнала от свободной жидкости.
Незаменимый режим для оптимизации изображения белого вещества. Используется в
МР диагностике рассеянного склероза, различных лейкопатий и т.д.
FLAIR
Слайд 37
Диффузионно-взвешенная томография — методика магнитно-резонансной томографии, основанная на регистрации
скорости перемещения меченных радиоимпульсами протонов.
Первоначально и наиболее эффективное
применение при диагностике острого нарушения мозгового кровообращения, по ишемическому типу, в острейшей и острой стадиях.
Сейчас активно используется в диагностике онкологических заболеваний.
Диффузионно-взвешенная томография
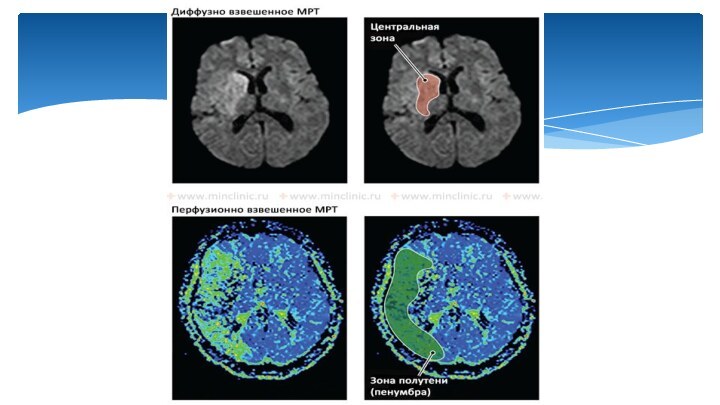
Слайд 39
Диффузионно-взвешенное МРТ (DWI) показывает гиперинтенсивность, которая соответствует необратимой
ишемии в глубине басссейна правой средней мозговой артерии.
При
перфузионно-взвешенной МРТ (PWI) используется контрастное вещество для оценки мозгового кровотока. Цветовая шкала представляет собой усредненное время прохождения контрастного вещества через ткани мозга; синий цвет обозначает нормальное время транзита, а оттенки зеленого, желтого, оранжевого и красного указывают на задержку контраста (зоны ишемии).
Слайд 40
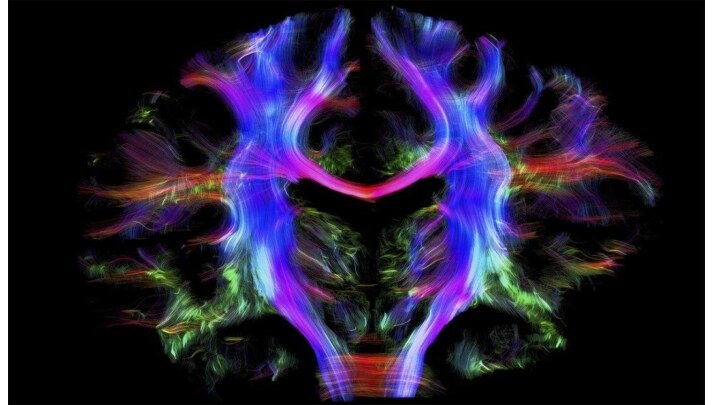
Диффузия в биологических тканях ограничена множеством препятствий, такими
как стенки клеток и нейронные тракты, а характеристики диффузии
в тканях изменяются при некоторых заболеваниях центральной нервной системы.
Измерив тензор диффузии, можно рассчитать направление максимальной диффузии и тем самым получить информацию о геометрическом строении тканей человека, например, направлении крупных пучков нервных волокон.
Диффузионно-тензорная трактография
Слайд 44
Радионуклидный метод исследования внутренних органов .
Метод основан на регистрации
пары гамма-квантов, возникающих при аннигиляции позитронов с электронами.
Позитроны возникают при позитронном бета-распаде радионуклида,
входящего в состав радиофармпрепарата , который вводится в организм перед исследованием.
При аннигиляции позитронов с электронами, находящимися в тканях организма, почти всегда возникает два гамма-кванта.
Используя большой набор детекторов, расположенных вокруг исследуемого объекта (или перемещая пару детекторов вокруг объекта), можно построить в пространстве множество прямых. Все они будут проходить через точки, в которых происходила аннигиляция (то есть через точки, где находится распавшееся ядро радионуклида — с точностью до очень короткой длины пробега позитронов в ткани).
Благодаря этому можно выполнить трёхмерную реконструкцию распределения радионуклида в сканируемом объекте.
Слайд 45
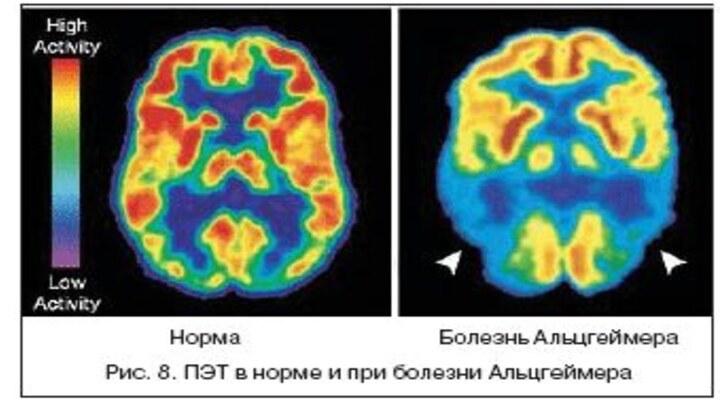
Получение функциональных изображений ПЭТ позволяет получать функциональные изображения, отражающие
процессы жизнедеятельности органов и тканей организма человека на молекулярном
уровне, включая метаболизм глюкозы и утилизацию кислорода, оценку кровотока и перфузии, оценку концентрации и сродства специфических рецепторов.
Слайд 47
Аналоги природной глюкозы: 18 F-фтордезоксиглюкоза ( 18 F-ФДГ),
[1- 11 C]-D-глюкоза- используются для оценки скорости метаболизма глюкозы,
Меченная вода служит для оценки мозгового кровотока, [ 15 O 2 ]– для оценки метаболизма кислорода.
[ 11 C]-метил-L-метионин, [ 11 C]-лейцин, [ 18 F]-тирозин, 18 F -фторхолин– для определения уровня метаболизма и транспорта аминокислот и синтеза белков,
18 F -фтортимидин для оценки скорости пролиферации опухолевых клеток, 18 F -фтормизонидазол для выявления тканевой гипоксии.
Радиофармпрепараты
Слайд 49
Разновидность эмиссионной томографии; диагностический метод создания томографических изображений распределения радионуклидов.
В
ОФЭКТ применяются радиофармпрепараты, меченные радиоизотопами, ядра которых при каждом акте радиоактивного
распада испускают только один гамма-квант (фотон) (для сравнения, в ПЭТ используются радиоизотопы, испускающие позитроны).
Применяется для диагностики опухолей головного мозга
Данная технология позволяет формировать 3D-изображения
Single-photon emission computed tomography, SPECT
Слайд 50
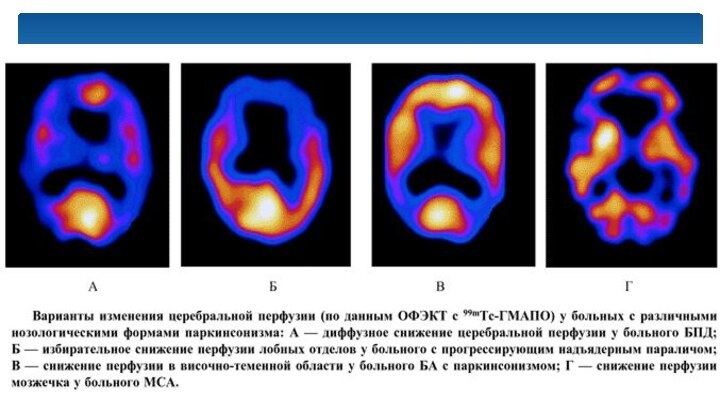
По результатам ОФЭКТ можно судить:
- об особенностях
кровоснабжения;
- о насыщении кислородом различных тканей;
- о
характере обменных процессов.
Это дает возможность специалистам определить наличие проблемных зон тогда, когда:
- опухолевые клетки уже появились, но опухоль еще не сформировалась;
- у рака нет четких границ.
Слайд 53
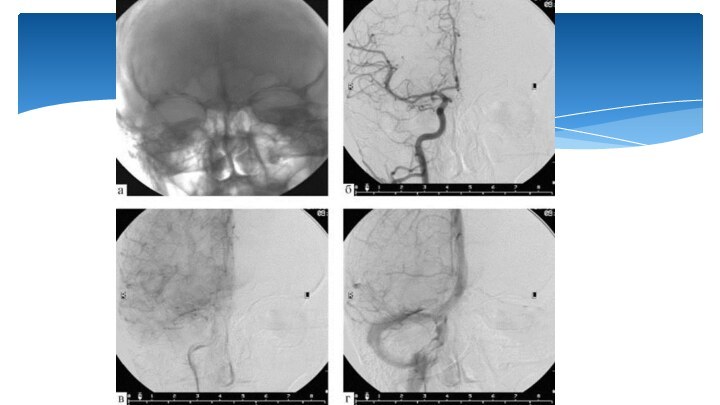
Rонтрастное исследование сосудов с последующей компьютерной обработкой.
Оно
позволяет получить снимки высокого качества с выделением отдельных сосудов
из общей картины, при этом можно уменьшить количество вводимого контрастного вещества и это вещество можно вводить внутривенно, не прибегая к катетеризации артерии, что менее травматично для пациента.
Digital subtraction angiography (DSA)


























![Современные методики нейровизуализации: эксплуатационный обзор Аналоги природной глюкозы: 18 F-фтордезоксиглюкоза ( 18 F-ФДГ), [1- 11 C]-D-глюкоза- используются](/img/tmb/15/1418408/6ad72fff17beee0ef1c33a3c1eb6ce89-720x.jpg)