Слайд 2
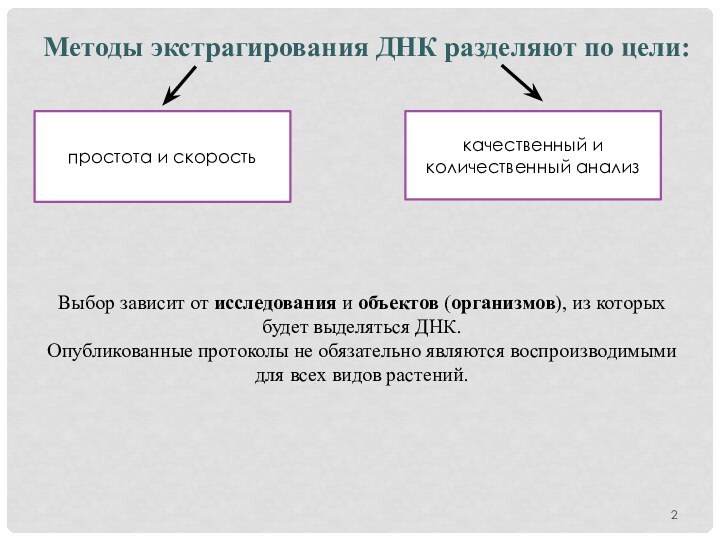
Методы экстрагирования ДНК разделяют по цели:
простота и скорость
качественный
и количественный анализ
Выбор зависит от исследования и объектов (организмов),
из которых будет выделяться ДНК.
Опубликованные протоколы не обязательно являются воспроизводимыми для всех видов растений.
Слайд 3
Важным условием при экстрагировании ДНК является
использование дополнительной промывки
со специальными буферными растворами и изопропанолом в методах.
Слайд 5
Различные виды растений, растения и органы на различных
стадиях развития, даже различные органы одного вида на одной
стадии развития растения содержат различные количества и классы вторичных метаболитов и запасных веществ
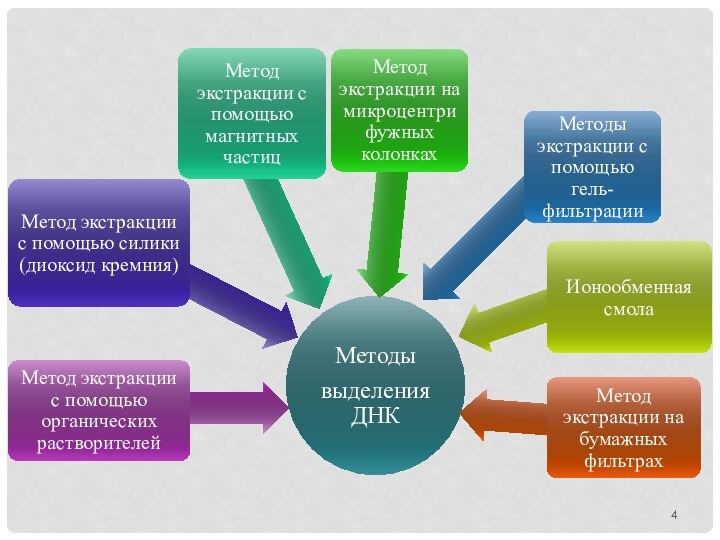
много модификаций выделения ДНК из растительных объектов
Слайд 6
Одним из наиболее широко применяемых является метод, основанный
на использовании буфера СТАВ. В одной из работ авторы
цитируют одиннадцать модификаций данного метода, которые включают не только различные концентрации собственно буфера, но и добавление протеиназы К, меркаптоэтанола, использование смеси фенол/хлороформ/изоамиловый спирт (25:24:1), и затем хлороформ/ изоамиловый спирт (24:1) и др. для лучшей очистки ДНК.
Слайд 7
СТАВ-буфер: 2% СТАВ(10,0 г), 1,4 M NaCI (40,91

г), 20 мM ЭДТА (20 мл 0,5 M ЭДТА),
100 мM Tris-HCI pH 8 (50 мл 1М Tris-HCI) добавить дистиллированную воду до конечного объёма 500 мл.
ТЕ-буфер: 10 мM Tris-НС1, рН 8,0; 1 мM ЭДТА. Хранить при 2-8°С.
1. Примерно 2 см2 листьев положить в 1,5 мл пробирку. (Можно положить лист на пробирку и надавливанием крышки выдавить два-три круга).
2. Добавить 400 мкл СТАВ 2%-буфера и быстро в течении 30 сек измельчить с помощью палочки-измельчителя.
3. Добавить 10 мкл РНКазы и 5 сек. встряхнуть на встряхивателе.
4. Инкубировать 60-80 мин при 65°С на водяной бане или сухом нагревателе, периодически аккуратно взбалтывать.
5. Добавить 400 мл очистительного раствора хлороформ-изоамиловый спирт (очистительный раствор: 92% хлороформа и 8% изоамилового спирта).
6. Центрифугировать 1 мин при максимальной скорости (13000 об/мин).
7. Осторожно пипеткой отобрать верхнюю фазу (постараться не захватить промежуточную пленку) и перенести в новую пробирку.
8. Повторить пункты 5-7.
9. Добавить 350 мл холодного изопропанола и тщательно перемешать растворы не допуская энергичного встряхивания.
10. Центрифугировать 10 мин при максимальной скорости (13000 об/мин).
11. Изопропанол акуратно слить и осажденную ДНК прополоскать в 70% этаноле.
12. Центрифугировать 5 мин при максимальной скорости (13000 об/мин).
13. Спирт слить и ДНК оставить в открытой пробирке для сушки (часто достаточно около 1 часа).
14. Высохшую ДНК растворить в дистилированной воде или для долгого хранения ДНК лучше растворить в ТЕ-буфере.
Слайд 8
Высокое содержание полисахаридов и полифенолов
использование СТАВ и высоких
концентраций солей не гарантирует полного избавления от полисахаридов;
способ выделения
ДНК из взрослых листьев с использованием для очистки колонки с Sephacryl S-1000 и последующим осаждением ДНК с (PEG 8000). Использование очищенной таким способом ДНК дало положительные результаты в ПЦР, рестрикции и (Southern-blot) анализе.
Слайд 9
Суккулентные виды
содержат очень большое количество слизеобразных веществ
разработан протокол,
основанный на принципе осаждения одного компонента, тогда как другой
остается в растворе (для представителя суккулентов Sedum telephium).
К гомогенату замороженных в жидком азоте листьев первоначально добавляли 5 объемов буфера экстракции (100 mM Tрис-HCl, pH 8,0; 20 mM Na2 EDТА; 2% w/v CTAB; 1,4 M NaCl; 1% w/v PVP). Процедура осаждения повторялась трижды с изменяющейся концентрацией буфера. Осадок растворялся в ТЭ-буфере с 1,0 M NaCl, осаждался в двух объемах этанола при низкой температуре и отмывался дважды 70%-ным спиртом. Осадок растворялся 0,2 объемами 12 M LiCl. Освобождение от РНК осуществлялось РНКазой.
Слайд 10
Кактусы
Выделение ДНК из представителей родов кактусов Hylocereus
и Selenicereus включало следующие основные стадии: трехкратное отмывание растертой
ткани в буфере экстракции; экстракция в СТАВ буфере с высокой концентрацией соли (4M NaCl) для удаления остатков полисахаридов;
удаление РНК с помощью РНКазы; экстракция фенолом/хлороформом для удаления белков; экстракция хлороформом для удаления остатков фенолов. Выход ДНК - от 0 до 20 мг/г свежих корней.
способ избавления от высоких концентраций полисахаридов
Слайд 11
винограда (Vitis spp.),
яблони (Malus spp.),
груши (Pyrus

spp.)
хвойных (Pinus densiflora, Pinus koraiensis, Taxus cuspidata, Juniperus chinensis)
Выделение ДНК из листьев нескольких видов
На начальном этапе листовой материал (несколько листовых дисков, что избавило от процедуры взвешивания и от возможной контаминации при взвешивании) растирали в пробирке в капле 1% (v/v) 2-меркаптоэтанола после чего добавляли 300 мкл буфера (250 mM NaCl, 25 mM EDTA, 0,5% SDS, 200 mM Tris–HCl, pH 8,0). Гомогенат инкубировали при комнатной температуре 1 час. На следующей стадии к гомогенату добавляли 5 мкл свежеприготовленного растворимого PVP в конечной концентрации 6% (soluble PVP, Sigma, MW 10 000), затем половину объема 7,5 M ацетата, инкубировали на льду 30 минут и центрифугировали 10 мин. при 10000 g, 40C. Супернатант переносили в чистую пробирку, добавляли 1 объем изопропанола и осаждали ДНК 30 мин. при –20 0 С. После 10 мин. центрифугирования при 10000 g осадок ДНК высушивали в вакууме. После соответствующей очистки от РНК и пигментов показатель А260/А280 растворенных образцов ДНК был в пределах 1,8
Слайд 12
Добавление 40 mM аскорбиновой кислоты при понижении pH
экстрагирующего раствора в сочетании с меркаптоэтанолом предотвращало окисление полифенолов
и связывание с ДНК и тем самым повышало качество последней, показатель А260/А280 был около 1,8
Слайд 13
Лекарственное растение Terminalia arjuna
при использовании различных модификаций СТАВ
метода была добавлена стадия доочистки на колонках (Genelute plant
genomic DNA extraction kit- G2N 70, Sigma Aldrich). Препарат ДНК, полученный таким способом, успешно был применен в исследовании генетического разнообразия популяции Terminalia arjuna в Индии.
Слайд 14
Клубника
Взрослые листья сразу после сбора фиксировали жидким азотом
и хранили при –70 0 С. Замороженные образцы растирали
в центрифужных полипропиленовых пробирках и добавляли буфер экстракции (100 mM Tris, 1,4 M NaC1, 20 mM EDTA, pH 8,0, 2% CTAB, 0,3% меркаптоэтанол, 50 мг PVP/ 0,5 г ткани), инкубировали при 60оС 25-60 мин. ПВП образовывал комплекс с полифенолами, отделяя их от ДНК. Высокая концентрация соли способствовала удалению полисахаридов.
Час обработки РНКазой был достаточен для деградации РНК.
Исследователи предполагают, что протокол
можно использовать для других представителей семейства Rosaceae, содержащих высокие концентрации полисахаридов и полифенолов.
Слайд 15
Подсолнечник
Дополнение к методам экстракции ДНК - сразу после
гомогенизации образцов, замороженных при –80 0 С, отмывали их
в течение 5 мин в буфере отмывания (100 mM Tris-HCl, pH 8,0; 50 mM EDTA, 1 M NaCl; 1% 2-меркаптоэтанол; 1% PVP k-30, SABCавс) во льду. После центрифугирования при 4 0 С верхний водный слой отбрасывался, а к остатку добавлялся буфер экстракции (2% CTAB; 1,42 M NaCl; 200 mM EDTA; 100 mM Tris-HCl, pH 8,0; 1% 2-меркаптоэтанол; 1% PVP), нагретый до 65 0 С. В результате дальнейших процедур выделения ДНК была исключительно чистой (260/280 нм в пределах 1,80-1,89) и успешно использовалась для рестрикции и других молекулярных исследований. Был сделан также вывод, что не следует использовать больше 200-300 мг образца для процедуры выделения, в противном случае избежать отрицательного действия полифенолов, полисахаридов и др. не удается.
Слайд 16
ВЫДЕЛЕНИЕ ДНК ИЗ ЛИСТЬЕВ VITIS VINIFERA L.
Проблема при
выделении ДНК из винограда – присутствие повышенного содержания полисахаридов
и полифенолов;
Большинство протоколов с некоторыми ограничениями (можно использовать при
определенных условиях и данная ДНК не всегда амплифицируема в методах ПЦР, секвенирования и других манипуляциях).
Культурный виноград V.vinifera subsp.sativa
Дикий предок культурного винограда V.vinifera subsp.silvestris Gmel.
Объекты исследования:
Слайд 17
1. СИЛИКА-МЕТОД № 1 (классический).
Растворы для выделения:
• Экстракционный

буфер: 10 г CTAB; 140 мл 5 M NaCl;
25 мл 2 M Tris-HCl (pH 8); 20 мл 0.5 M EDTA (pH 8). Довести до объема в 500 мл чистой водой и проавтоклавировать.
• Раствор силики: смешать 1 часть частиц силики (Sigma S-5631) с 1 частью (к объему) стерилизованной воды (1 г–к–1 мл). Все приготовления проводить под вытяжкой. Тщательно перемешать и оставить на 12-24 ч. Затем вылить верхнюю жидкую фазу, нижний раствор с частицами оксида кремния «силики» повторно разбавить с аналогичным количеством воды, которая была добавлена в начале процесса приготовления. Перемещать на вортексе и дать отстояться в течение 5-10 ч, вылить верхнюю жидкую фазу и удалить остаток воды путем испарения. Повторить процедуру с добавлением воды и ее удаления из частиц;
Промывочный буфер: 25% изопропанол; 25% этанол; 100 мМ NaCl; 10мМ Tris-HCl (pH 7.4); 2 мМ EDTA (pH 8); довести до 100% объема чистой водой и проавтоклавировать;
• 5 M NaCl;
• 70% этанол;
• 5 M NaCl;
• Изопропанол;
• Рибонуклеаза A (Sigma R9009: 10 мг/мл).
• TE-буфер: 10 мМ Tris-HCl и 1 мМ EDTA, pH 8.0 и
проавтоклавировать.
Слайд 18
1) Добавить 1200 мл экстракционного буфера (добавить 0,2%
s-
меркаптоэтанола только перед использованием) и 2 мкл рибонуклеазы A
к
растительному материалу и перемешать на вортексе.
2) Инкубировать при 37° C от 5 мин. до 10 часов.
3) Добавить 500 мл хлороформа: спирт и перемешать тщательно 20-25 мин.
4) Отцентрифугировать при 6000 оборотах 15 мин. при
комнатной температуре.
5) Перенести верхнюю фазу в новую пробирку.
6) Добавить 200–800 мкл раствора с частицами оксида кремния и
перемешивать в течение 5 мин. по часовой стрелке.
7) Отцентрифугировать при максимальных оборотах в течение 1мин.
8) Удалить супернатант аккуратно.
9) Промыть промывочным буфером путем добавления 1000 мл.
10) Отцентрифугировать при максимальных оборотах в течение 1мин.
Протокол выделения:
Слайд 19
11) Удалить супернатант аккуратно.
12) Повторить шаги 9, 10
и 11.
13) Высушить в течение 37° C 3 мин.
и перевернуть пробирки для
легкого высушивания.
14) Растворить белый осадок в 400 мкл TE.
15) Инкубировать 68° C в течение 15 мин.
16) Отцентрифугировать при максимальных оборотах в течение 1 мин. и перенести супернатант в новую пробирку.
17) Промыть ДНК путем добавления 0.1 объема 5 M NaCl; затем добавить к общему объему 60% изопропанола.
18) Перемешать 1 мин., отцентрифугировать при максимальных оборотах в течение 1 мин., удалить супернатант.
19) Промыть осадок 70% этанолом.
20) Отцентрифугировать при максимальных оборотах в течение 1мин. и вылить супернатант.
21) Определить качество ДНК на спектрофотометре при длине волны A260.
22) Положить при -70° C на длительный период хранения и -20° C на короткий период хранения.
Слайд 20
2. СИЛИКА-МЕТОД № 2, модифицированный под виноградную культуру

кафедрой виноградарства КубГАУ.
Растворы для выделения:
• Экстракционный буфер: 2 мM
Tris-HCl (pH 8,0); 20 мМ; 20 мМ
EDTA (pH 8,0) и 5 М гуанидиний тиоционат. Довести до необходимого объема и проавтоклавировать;
• Раствор силики: смешать 1 часть частиц силики (Sigma S-5631) с 1 частью (к объему) стерилизованной воды (1 г–к–1 мл). Все приготовления проводить под вытяжкой. Тщательно перемещать и оставить на 12-24 ч.
Затем вылить верхнюю жидкую фазу, нижний раствор с частицами силики заново разбавить с аналогичным количеством воды, которая была добавлена в начале процесса приготовления. Перемешать на вортексе и дать отстояться в течение 5-10 ч, вылить верхнюю жидкую фазу и удалить остаток воды путем испарения. Повторить процедуру с добавлением воды и ее удаления из частиц;
• Промывочный буфер I (силика 1): 50 мМ CH3COONa (pH 5,2); 20 мМ EDTA (pH 8); 5 M гуанидиний тиоционат или гидрохлорид; довести до 100% объема чистой водой и проавтоклавировать;
• Промывочный буфер II (силика 2): 25% изопропанол; 25% этанол; 100 мМ NaCl; 10 мМ Tris-HCl (pH 8,0); 2 мМ EDTA (pH 8,0); довести до 100% объема чистой водой и проавтоклавировать;
• CH3COONa (pH 5,2);
• Изопропанол;
• TE-буфер: 10 мМ Tris-HCl (pH 8,0) и 1 мМ EDTA (pH 8,0). Раствор проавтоклавировать.
Слайд 21
1) К размолотому в жидком азоте растительному материалу
добавить
1000 мл экстракционного буфера.
2) Инкубировать при 37° C от
5 до 10 мин.
3) Отцентрифугировать при 12000 оборотах 3 мин. при
комнатной температуре.
4) Перенести верхнюю фазу в новую пробирку.
5) Добавить 4–5 мкл раствора с частицами силики и 25-30 мкл
CH3COONa перемешивать в течение 5 мин. по часовой стрелке.
6) Отцентрифугировать при 12000 оборотах в течение 10 сек.
7) Удалить супернатант аккуратно.
8) Промыть раствором силики 1 путем добавления 500-700 мл.
9) Перемешать его на вортексе в течение 1 мин.
10) Отцентрифугировать при 12000 оборотах в течение 10 сек.
11) Удалить супернатант аккуратно, не выливая белый осадок.
12) Повторить шаги 8, 9, 10 и 11.
Протокол выделения:
Слайд 22
13) Промыть раствором силики 2 путем добавления 1000
мл.
14) Перемешать его на вортексе в течение 1 мин.
15)
Отцентрифугировать при 12000 оборотах в течение 10 сек.
16) Удалить супернатант аккуратно, не выливая белый осадок.
17) Повторить шаги 13, 14, 15 и 16.
18) Промыть изопропанолом путем добавления 1000 мл.
19) Отцентрифугировать при 12000 оборотах в течение 10 мин.
20) Высушить в течение 37° C 3 мин. и перевернуть пробирки для легкого высушивания.
21) Растворить белый осадок в 50 мкл TE.
22) Инкубировать 37° C в течение 15 мин.
23) Отцентрифугировать при максимальных оборотах в течение 1 мин. и перенести супернатант в новую пробирку.
24) Определить качество ДНК на спектрофотометре при длине волны A260.
25) Положить при -70° C на длительный период хранения и -20° C на короткий период хранения.
Слайд 23
Экстракция с помощью силики
К клеточному экстракту добавляется гуанидинтиоцианат
Денатурируют
все компоненты, за исключением ДНК
Связывание ДНК с частицами силики
(силика может вноситься прямо в образец или образец пропускают через колонку с силикой)
Отмывка от клеточных компонентов
ДНК элюируется в раствор
Слайд 24
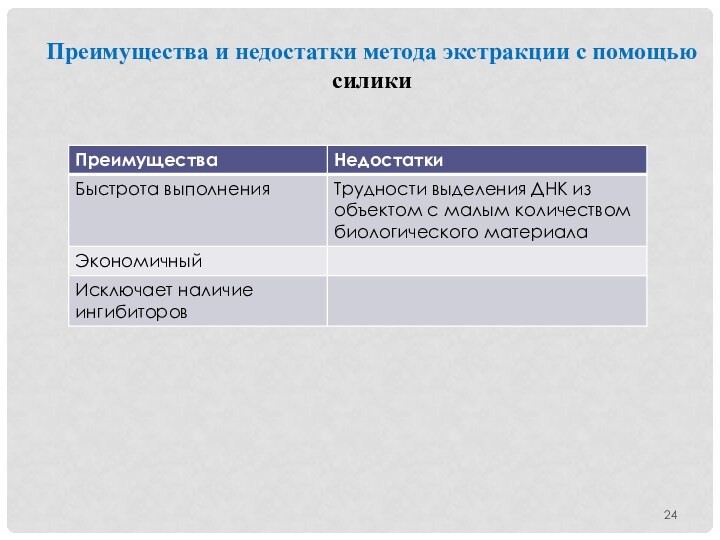
Преимущества и недостатки метода экстракции с помощью силики
Слайд 25
3. SDS-МЕТОД (метод выделения ДНК с использованием додецилсульфат
натрия).
Растворы для выделения:
• Экстракционный буфер: 0.1 M Tris (pH
8.0), 0.05 M EDTA (pH 8.0),
0.5 M NaCl, и 0.01 M B-меркаптоэтанол;
• 5 M ацетат калия;
• Изопропанол;
• 20% додецилсульфат натрия (SDS);
• Поливинилполипирролидона (PVP) (Sigma, P6755);
• 70% этанол;
• TE-буфер: 10 мМ Tris-HCl (pH 8,0) и 1 мМ EDTA (pH 8,0). Раствор
проавтоклавировать.
Слайд 26
1) К размолотому в жидком азоте растительному материалу
добавить 1000 мл экстракционного буфера и 100 мкл 20%
SDS.
2) Инкубировать при 65° C от 30 мин.
3) Добавить 500 мкл раствора 5M ацетат калия и перемешивать в течение 5 мин.
4) Инкубировать при 4° C от 30 мин.
5) Отцентрифугировать при 12000 оборотах 3 мин. при 4° C и комнатной температуре.
6) Перенести верхнюю фазу в новую пробирку.
7) Добавить 1000 мкл холодного изопропанола.
8) Собрать выпавший белый осадок крюком и перенести в новую пробирку.
9) Промыть осадок 700 мкл холодным 70% спиртом.
10) Отцентрифугировать при 12000 оборотах в течение 10 сек.
11) Удалить супернатант аккуратно.
Протокол выделения:
Слайд 27
12) Высушить в течение 37° C 3 мин.
и перевернуть пробирки для легкого высушивания.
13) Растворить белый осадок
в 50 мкл TE.
14) Инкубировать 37° C в течение 15 мин.
15) Отцентрифугировать при максимальных оборотах в течение 1мин. и перенести супернатант в новую пробирку.
16) Определить качество ДНК на спектрофотометре при длине волны A260.
17) Положить при -70° C на длительный период хранения и -20° C на короткий период хранения.
Слайд 29
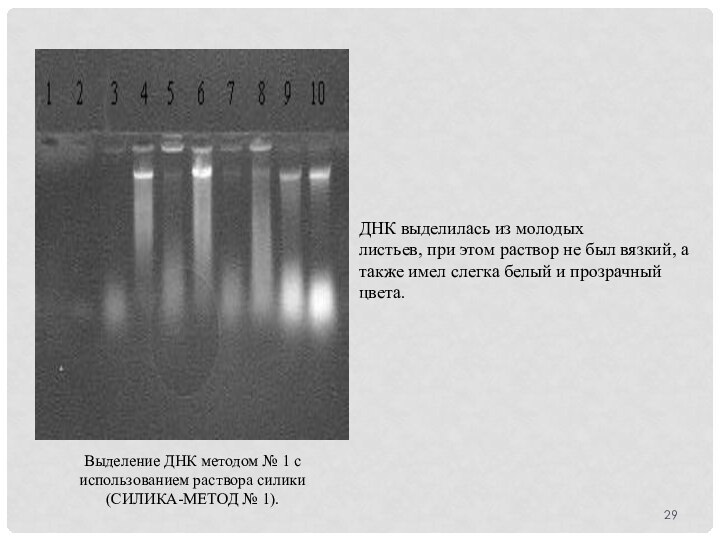
Выделение ДНК методом № 1 с использованием раствора
силики (СИЛИКА-МЕТОД № 1).
ДНК выделилась из молодых
листьев, при этом
раствор не был вязкий, а также имел слегка белый и прозрачный цвета.
Слайд 30
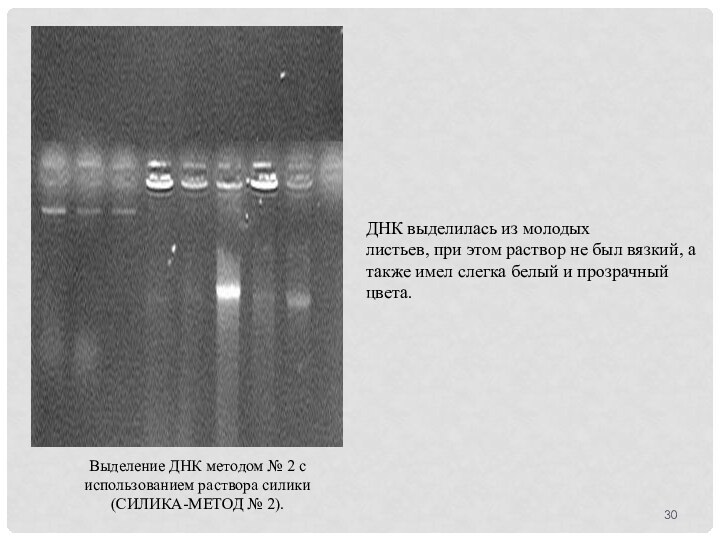
Выделение ДНК методом № 2 с использованием раствора
силики (СИЛИКА-МЕТОД № 2).
ДНК выделилась из молодых
листьев, при этом
раствор не был вязкий, а также имел слегка белый и прозрачный цвета.
Слайд 31
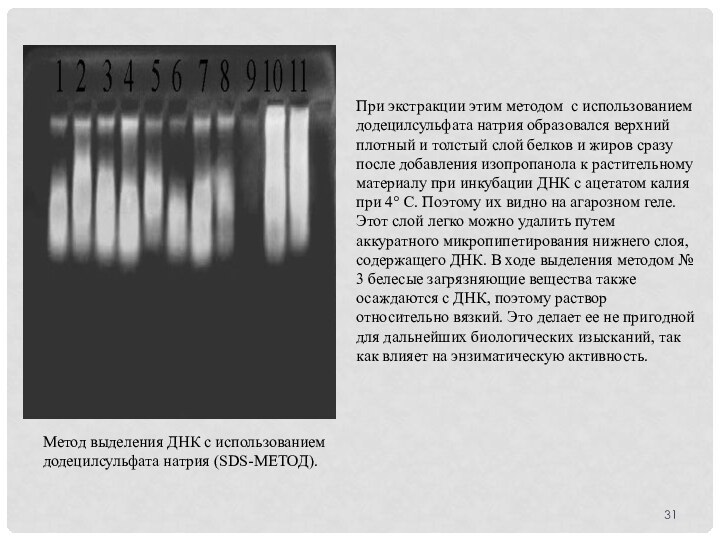
Метод выделения ДНК с использованием додецилсульфата натрия (SDS-МЕТОД).
При
экстракции этим методом с использованием додецилсульфата натрия образовался верхний
плотный и толстый слой белков и жиров сразу после добавления изопропанола к растительному материалу при инкубации ДНК с ацетатом калия при 4° C. Поэтому их видно на агарозном геле. Этот слой легко можно удалить путем аккуратного микропипетирования нижнего слоя, содержащего ДНК. В ходе выделения методом № 3 белесые загрязняющие вещества также осаждаются с ДНК, поэтому раствор относительно вязкий. Это делает ее не пригодной для дальнейших биологических изысканий, так как влияет на энзиматическую активность.
Слайд 32
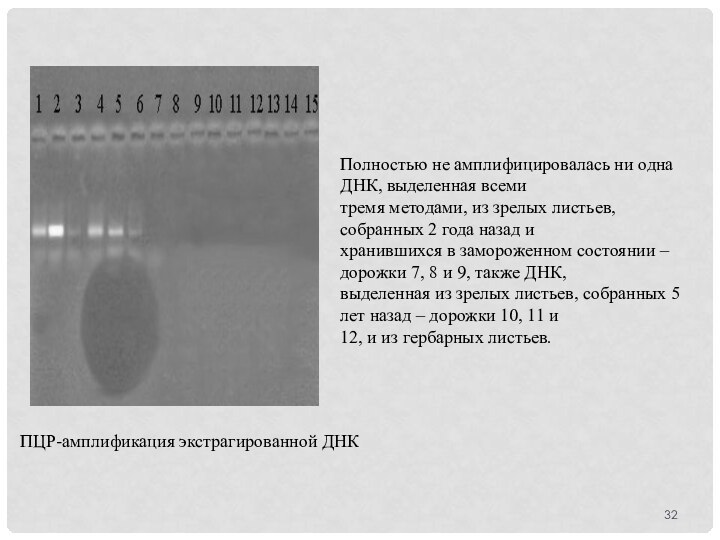
Полностью не амплифицировалась ни одна ДНК, выделенная всеми
тремя
методами, из зрелых листьев, собранных 2 года назад и
хранившихся
в замороженном состоянии – дорожки 7, 8 и 9, также ДНК,
выделенная из зрелых листьев, собранных 5 лет назад – дорожки 10, 11 и
12, и из гербарных листьев.
ПЦР-амплификация экстрагированной ДНК
Слайд 33
лучшие результаты были получены с использованием метода №
2, так как он позволяет получать высокого качества ДНК;
метод
№ 1 показал удовлетворительные результаты при
выделении ДНК из молодых листьев, но ДНК из выделенных образцов была сильно загрязнена и поэтому требует дальнейшей очистки;
метод № 3 не является пригодным для выделения ДНК из
виноградных листьев, так как ДНК из выделенных образцов была сильно загрязнена и практически не амплифицировалась.
Использование гуанидин тиоционатового базового экстрагирующего раствора позволяет во второй методике экстрагировать более качественную ДНК и очистить ее от различных примесей, присутствующих в растворе. Применение в качестве базового раствора SDS–буфера резко сокращает количество ДНК, которое может быть использовано для амплификации ДНК по сравнению с методами СТАБ и раствора оксида кремния.
Слайд 34
Список использованных источников:
Рябушкина Н.А., Омашева М.Е., Галиакпаров Н.Н.
Специфика выделения ДНК из растительных объектов// Биотехнология. Теория и
практика. – 2012. – №2. С. 9-25;
(www.biotechlink.org/Articles.aspx? articleID=55)
www.molbiol.edu.ru/protocol/;
Звягин А.С., Трошин Л.П. Выделение ДНК из листьев Vitis vinifera L. // Научный журнал КубГАУ. – 2010. – №60(06). С.1-17;
www/molbiol.ru/protocol/;
www.diamond-dna.ru/metod;