Слайд 2
План урока:
1. Проверка домашнего задания.
2. Многогранники
на страже spᵌ-гибридизации.
3. Фигуры на плоскости в sp²-гибридизации.
4.Геометрия в
sp-гибридизации.
5. Рефлексия.
Слайд 4
Вспомним многогранники.
Дадим определение правильного многогранника.
Заполним
таблицу.
Слайд 5
«5» – нет ошибок и помарок
«4» – до
2-х ошибок
«3» от 3-х до 4-х ошибок
Проверь себя.
Слайд 6
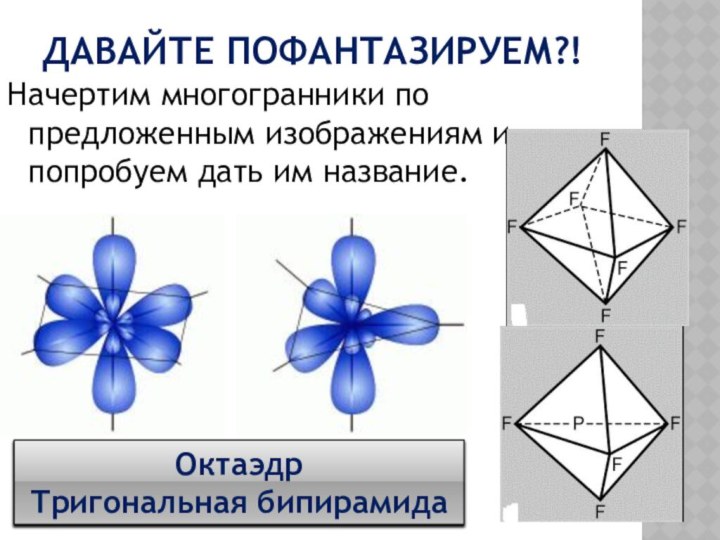
Давайте пофантазируем?!
Начертим многогранники по предложенным изображениям и попробуем
дать им название.
Октаэдр
Тригональная бипирамида
Слайд 8
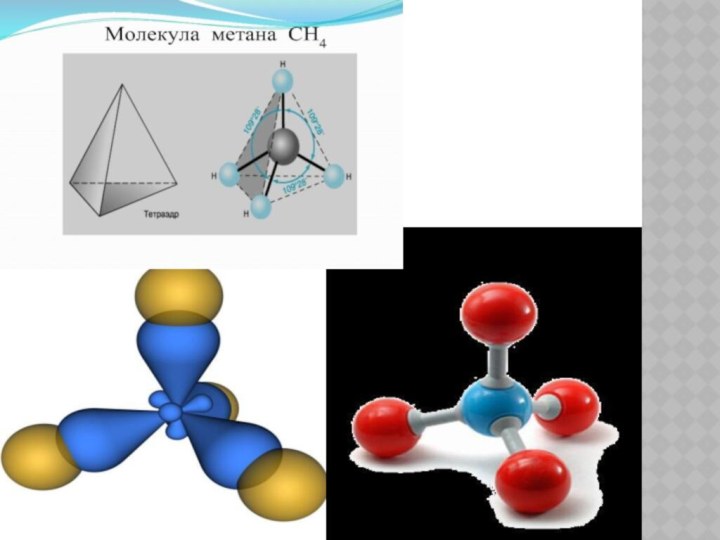
Строение молекулы метана.
Метан –
простейший представитель предельных
углеводородов, его молекулярная формула
СН4;
структурная формула: электронная формула:
Поэтому строение предельных углеводородов рассматривают на примере метана.
Слайд 9
Атом углерода находится во 2-м периуде и на
его внешней оболочке имеются 2 спаренных S-электрона и 2
неспаренных Р-электрона:
Слайд 11
Ответьте на вопросы теста №1
1.Сколько гибридных орбиталей и
какой
формы образуется при sp3-гибридизации?
а) 2S- облака и 2Р-облака;
б)
1S- облако и 2Р-облака;
в) 1S-облако и 3Р –облака;
2. Молекула метана имеет форму:
а) конуса; б) пирамиды; в) тетраэдра.
3. Указать валентный угол между осями гибридных облаков:
а) 109°28‘ б) 120°28‘ в) 110°
Слайд 12
4. Для алканов характерна гибридизация:
а) SР -гибридизация;
б) SР3-гибридизация;
в) SР2-гибридизация.
5. Сколько химических связей и какого
типа образуется в молекуле метана?
а) 4 ковалентные связи;
б) 2 сигма –связи, 2 π-связи;
в) 4 сигма –связи;
Слайд 13
Стандарты ответов к тесту №1
Строение молекулы метана
Слайд 14
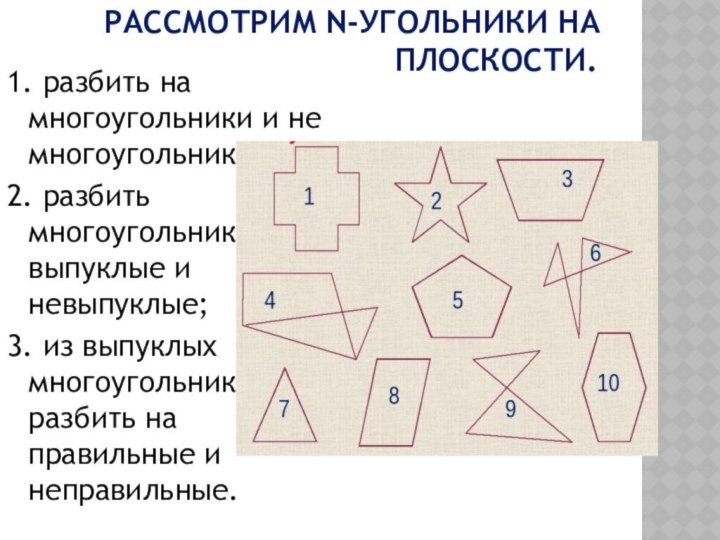
Рассмотрим n-угольники на
плоскости.
1. разбить на многоугольники и не многоугольники;
2. разбить многоугольники на выпуклые и невыпуклые;
3. из выпуклых многоугольников разбить на правильные и неправильные.
Слайд 15
Проверим себя.
«5» – нет ошибок и помарок
«4» –
до 3-х ошибок
«3» - от 4 до 6-ти ошибок
Слайд 16
Рассмотрим правильный треугольник.
Дадим определение:
Треугольник
называется
правильным, если все
его стороны и
углы
соответственно равны.
Слайд 17
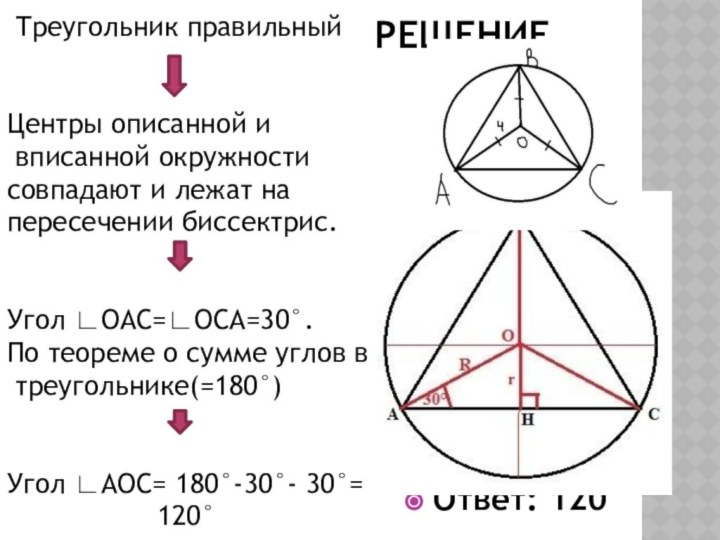
Решим задачу.
Определить угол ∟AОС.
Слайд 18
Решение.
Треугольник правильный
Центры описанной и
вписанной окружности
совпадают и
лежат на
пересечении биссектрис.
Угол ∟ОАС=∟ОСА=30°.
По теореме о сумме углов в
треугольнике(=180°)
Угол ∟АОС= 180°-30°- 30°=
120°
Ответ: 120°
Слайд 19
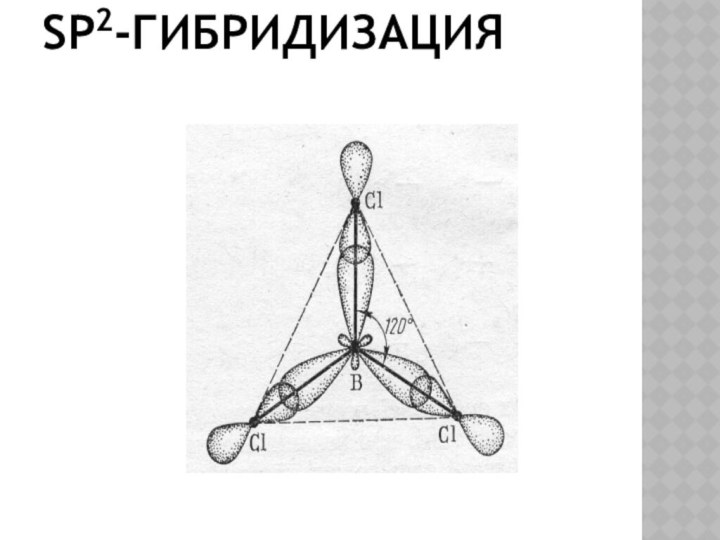
Вопрос.
1. Какой вид гибридизации
образуется гибридными
орбиталями,
расположенными в одной
плоскости и
направленными
к вершинам треугольника
под углом 120°?
2. В каких плоскостях находятся
оставшиеся
негибридные
р-орбитали?
Слайд 21
Строение молекулы этилена
Этилен- простейший представитель этиленовых углеводородов(алкенов), его
молекулярная формула:
Структурная формула Электронная формула
С2Н4
Поэтому строение
этиленовых углеводородов рассматривают на примере этилена.
Слайд 22
Строение молекулы этилена
В молекуле этилена гибридизации подвергаются
три
электронных облака атома углерода:
облака одного S – электрона
и двух р – электронов.
Гибридные облака лежат в одной плоскости,
принимают одинаковую форму несимметричных объемных восьмерок, вытянутых в одну сторону.
Угол между осями этих облаков 120°.
Этот вид гибридизации характерен и для диеновых углеводородов(алкадиены).
Слайд 23
Строение молекулы этилена
У атомов углерода остается еще по
одному p- электрону. Облака этих электронов не затронуты гибридизацией,
они не изменили своей формы и имеют вид симметричной объемной восьмерки.
Слайд 24
Строение молекулы этилена
Оси этих облаков будут перпендикулярны плоскости
атомных ядер. Эти электронные облака частично перекрываются между собой
выше и ниже плоскости атомных ядер, образуя вторую связь между атомами углеродов.
Эта вторая связь менее прочная, чем первая.
Связь, образующаяся при перекрывании электронных облаков вне плоскости ядер называется π- связью.
Слайд 25
Строение молекулы этилена
Объясняется непрочность π- связи следующим:
вращение атомов
углерода в молекуле возможно
в том случае, если они
соединены σ - связью. Появление π -связи лишает их свободного вращения. Поэтому свободное вращение атомов углерода вокруг π –связи возможно только, когда разорвется π–связь.
Слайд 26
Ответьте на вопросы теста №2
1. Какие углеводороды называют
этиленовыми?
а) Углеводороды с общей формулой СnH2n+2
б) Углеводороды с общей
формулой CnH2n-2
в) Углеводороды с общей формулой CnH2n
2. Вид гибридизации у этиленовых углеводородов:
a) Sp -гибридизация
б) Sp3 -гибридизация
в) Sp2 –гибридизация
Слайд 27
3. Угол между осями гибридных облаков атомов углерода
в молекуле этилена:
а) 1090 281 б) 1800
в) 1200
4. Сколько П-связей в молекуле этилена?
а) ни одной; б) две; в) одна;
5. Как располагаются П-связи в молекуле этилена?
а) В плоскости G- связей (в плоскости гибридных облаков);
б) В направлениях перпендикулярных плоскости G – связей (плоскости гибридных облаков);
в) Только в одном перпендикулярном направлении к плоскости G –связей (плоскости гибридных облаков);
Слайд 29
Сопоставим название с чертежами.
Дадим общее название изображениям.
1. отрезок
2.
луч
3. прямая
1.
2.
3.
Изображения – линейные!
Слайд 30
Случаи расположения лучей.
1.
2.
3.
4.
Рассмотрим полученные углы:
1. 180°
2. 0°
3.
90°
4. 90°
Слайд 31
Вспомним расположение плоскостей в пространстве.
Дадим определение.
Под углом 90°
Под
- острым или
- тупым углом
Слайд 32
Вопрос?
1. Какой вид гибридизации использует линейное расположение атомных
орбиталей под углом в
180°?
2. В каких плоскостях
находятся оставшиеся
негибридные
р - орбитали?
Слайд 34
Строение молекулы ацетилена.
Ацетилен –
простейший представитель предельных углеводородов(алкинов), его молекулярная формула: C2H2 ;
структурная формула: электронная формула:
H–C≡C–H H :С : : : С: Н
Поэтому строение ацетиленовых углеводородов рассматривают на примере ацетилена.
Слайд 35
Строение молекулы ацетилена
Молекула ацетилена имеет линейное строение. В
молекуле ацетилена у атомов углерода гибридизации подвергаются лишь два
облака:
одно S-облако и одно Р- облако.
Эти облака перекрываются с S-облаками 2-х атомов водорода и между собой образуя σ-связи. Угол между осями этих гибридных облаков 180°
Строение молекулы ацетилена
Облака двух других Р- электронов у атомов углерода не участвуют в гибридизации. Они сохраняют форму симметричных восьмерок расположенных во взаимно перпендикулярных
плоскостях, т.е. по перпендикулярным направлениям σ- связей.
Слайд 37
Ответьте на вопросы теста №3
1. Какие углеводороды называют
ацетиленовыми?
а)
Углеводороды с общей формулой СnH2n+2;
б) Углеводороды с общей формулой CnH2n ;
в) Углеводороды с общей формулой CnH2n-2
2. Вид гибридизации у ацетиленовых углеводородов ?
а) Sp2- гибридизация;
б) Sp – гибридизация;
в) Sp3- гибридизация.
Слайд 38
3. Угол между осями гибридных облаков атома углерода
в молекуле ацетилена:
а) 1200 ;
б) 109028’ ; в) 1800
4. Сколько П- связей в молекулах ацетиленовых углеводородов?
а) Ни одной; б) одна; в) две;
5. Как располагаются П- связи в молекуле ацетилена?
а) В плоскости G - связей
(в плоскости гибридных облаков);
б) Только в одном перпендикулярном направлении
к плоскости G - cвязей;
в) В направлениях перпендикулярных плоскости
G – связей ( плоскости гибридных облаков)
Слайд 40
Стань Эркюлем Пуаро!
Семь пядей
во лбу.
Собери
пазл.
Применение
знаний.
РЕФЛЕКСИЯ.
Слайд 41
Применение знаний
Определите тип гибридизации
в углеводородах:
1.
2. CH3—CH2—CH2—CH2—CH2—CH2—CH3
3.
CH3 – CН = C Н– CН2 – CH
= CH – CH3
4.
5. CH3 – CН = C Н—CH2—CH3
.
.
CH3– C ≡ C – CH3