- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему: Гибридизация орбиталей 10 класс 1 курс
Содержание
- 2. Содержание:Ковалентная связьНасыщаемостьПоляризуемостьНаправленностьТетраедрическое направление электронных парГипотеза о гибридизации электронных орбиталей атомовГибридизация электронных орбиталейSP3 SP3 гибридизацияsp2-Гибридизацияsp-Гибридизация
- 3. Ковалентная связьКовалентная связь наиболее распространена в мире органических и неорганических веществ.И характеризуется:НасыщаемостьюПоляризуемостьюНаправленностью в пространстве
- 4. Насыщаемость ковалентной связиНасыщаемость ковалентной связи состоит в
- 5. Электроны обладают способностью самопроизвольно перераспределяться по подуровням
- 6. ПоляризуемостьПоляризуемость ковалентной связи заключается в способности молекул
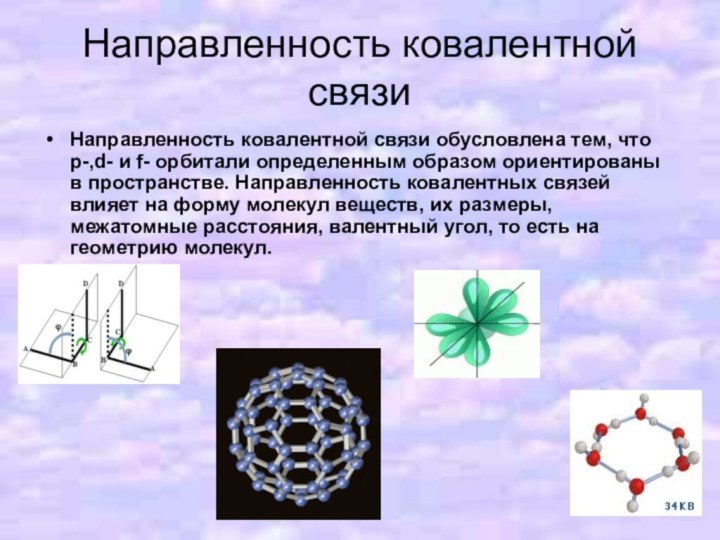
- 7. Направленность ковалентной связиНаправленность ковалентной связи обусловлена тем,
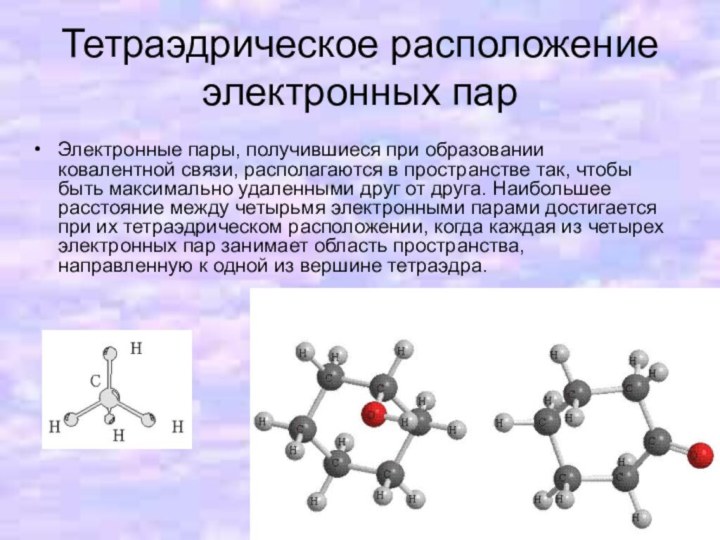
- 8. Тетраэдрическое расположение электронных парЭлектронные пары, получившиеся при
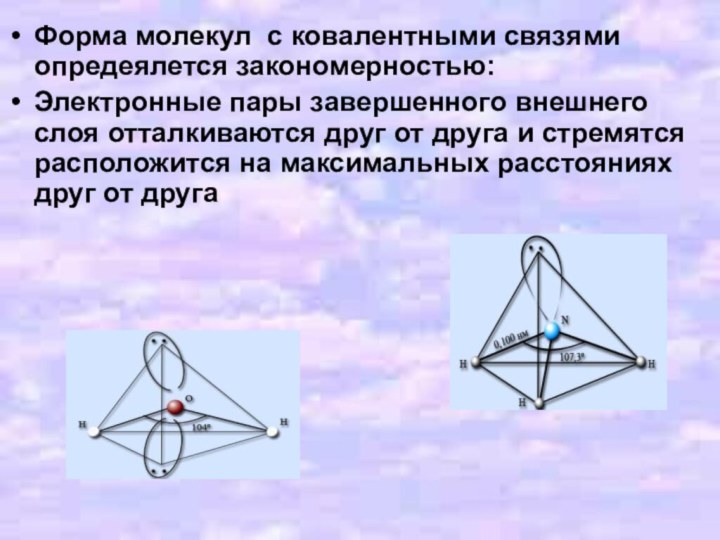
- 9. Форма молекул с ковалентными связями опредеялется закономерностью:Электронные
- 10. Гипотеза о гибридизации электронных орбиталей атомовОна была
- 11. Гибридизация электронных орбиталейГибридизация электронных орбиталей- процесс их взаимодействия, приводящий к выравниванию по форме энергии
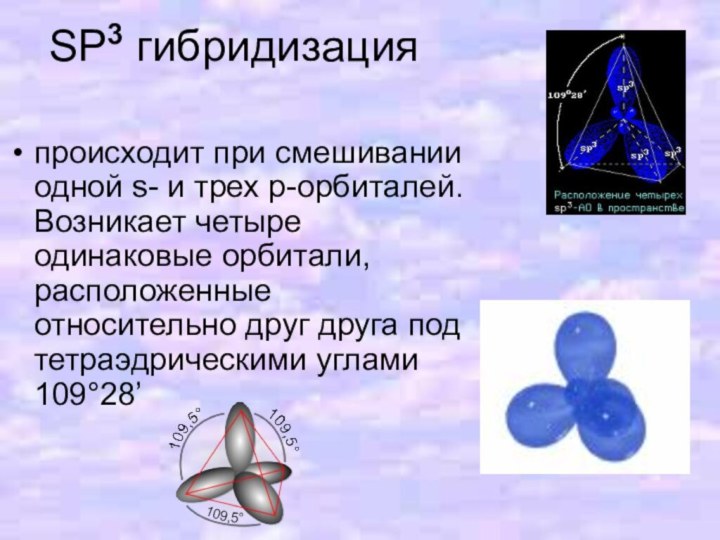
- 12. SP3 гибридизацияпроисходит при смешивании одной s- и
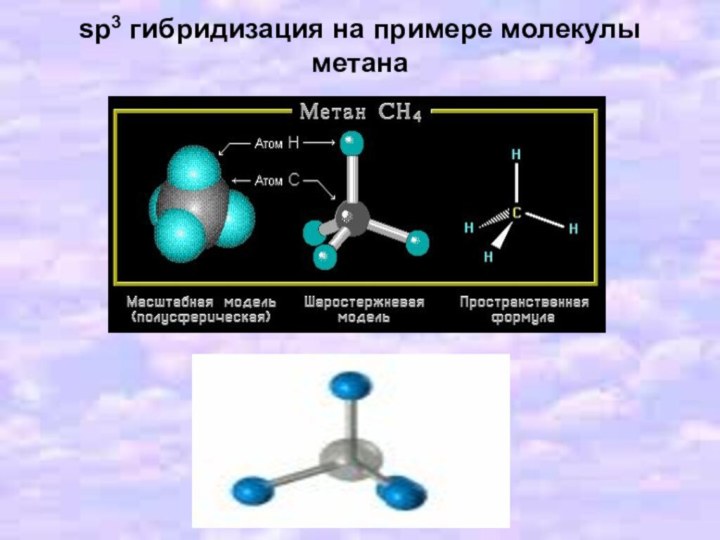
- 13. sp3 гибридизация на примере молекулы метана
- 14. sp2-Гибридизация (плоскостно-тригональная) Одна s- и две p-орбитали
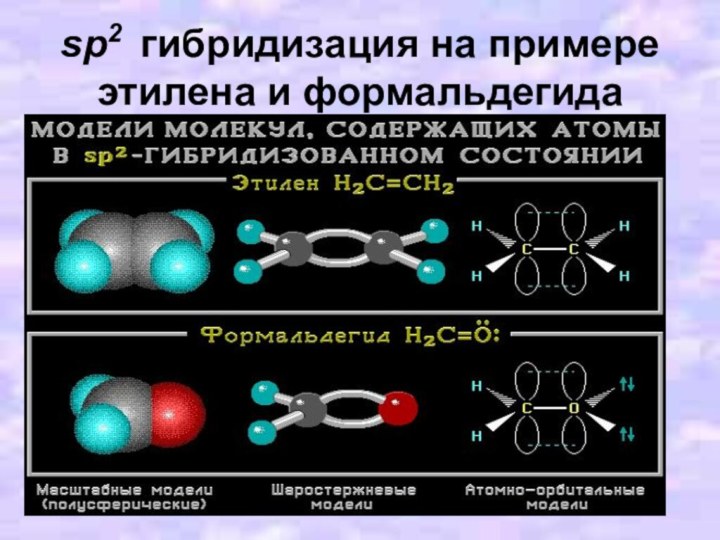
- 15. sp2 гибридизация на примере этилена и формальдегида
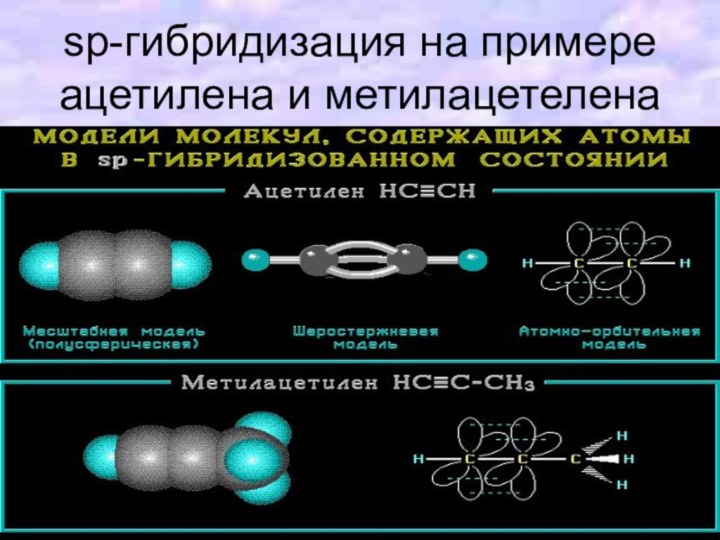
- 16. sp-Гибридизация (линейная) происходит при смешивании одной s-
- 17. sp-гибридизация на примере ацетилена и метилацетелена
- 18. Скачать презентацию
- 19. Похожие презентации
Содержание:Ковалентная связьНасыщаемостьПоляризуемостьНаправленностьТетраедрическое направление электронных парГипотеза о гибридизации электронных орбиталей атомовГибридизация электронных орбиталейSP3 SP3 гибридизацияsp2-Гибридизацияsp-Гибридизация







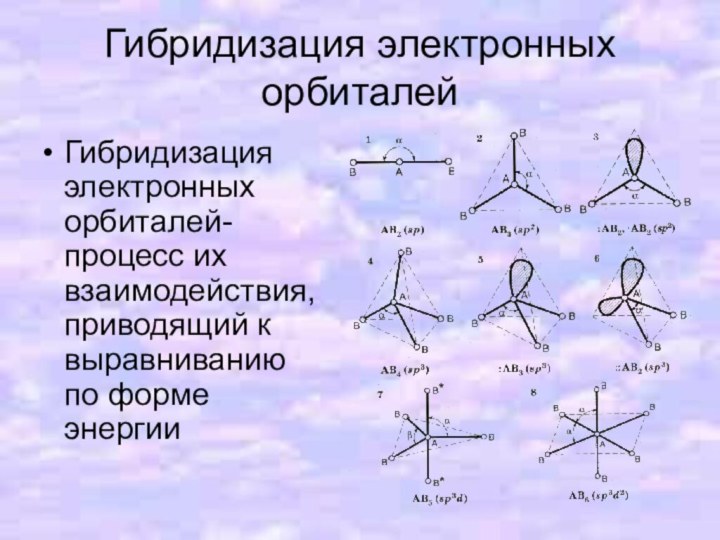



Слайд 2
Содержание:
Ковалентная связь
Насыщаемость
Поляризуемость
Направленность
Тетраедрическое направление электронных пар
Гипотеза о гибридизации электронных
орбиталей атомов
Слайд 3
Ковалентная связь
Ковалентная связь наиболее распространена в мире органических
и неорганических веществ.И характеризуется:
Насыщаемостью
Поляризуемостью
Направленностью в пространстве
Слайд 4
Насыщаемость ковалентной связи
Насыщаемость ковалентной связи состоит в том,
что число общих электронных пар, которые способен образовывать тот
или иной атом, ограничено. Благодаря этому ковалентные соединения имеют строго определенный состав.Слайд 5 Электроны обладают способностью самопроизвольно перераспределяться по подуровням в
пределах одного энергетического уровня (без изменения главного квантового числа).
Из четырёх валентных электронов неспаренными являются два и валентность углерода в данном случае равна двум.
Теперь все четыре валентных электрона распарены, и валентность углерода равна четырем.
Слайд 6
Поляризуемость
Поляризуемость ковалентной связи заключается в способности молекул (и
отдельных связей в них) изменять свою полярность под действием
электрического поля.В результате поляризации неполярные молекулы могут стать полярными, а полярные молекулы-превратиться в еще более полярные вплоть до полного разрыва отдельных связей с образованием ионов