Слайд 2
Тип урока: изучение нового материала и первичное закрепление
полученных знаний
Методы обучения: комбинированный( словесно-наглядный) с использованием технологии развития
критического мышления и информационных технологий
Цель урока: сформировать знания учащихся о химических свойствах солей
Задачи
- образовательные: изучить общие свойства солей, закрепить умение составлять уравнения реакций;
- развивающие: совершенствовать умение работать с источником информации; помочь осознать практическую значимость изучаемого материала;
- воспитательные: расширить кругозор учащихся, способствовать формированию коммуникативной компетентности в общении и сотрудничестве со сверстниками, в процессе образовательной деятельности
Слайд 4
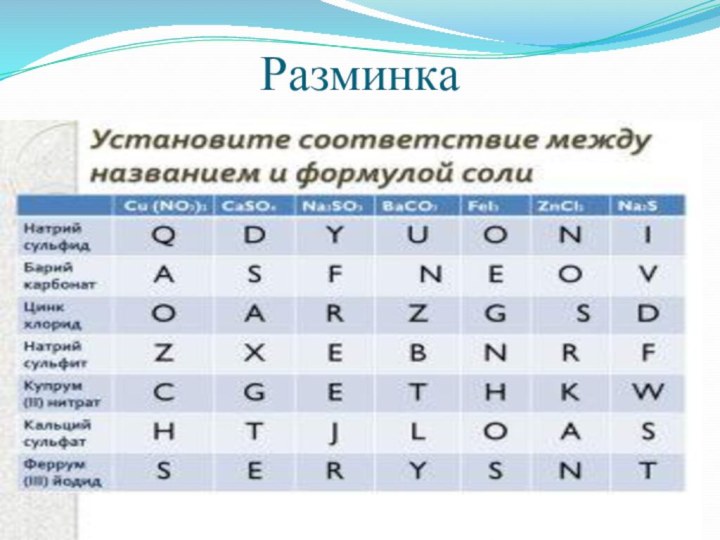
Самостоятельная работа
Допиши реакции
Fe+CuSO4→
Al+CuCl2→
BaCl2+H2SO4→
CaCO3+HCl→
Ni(NO3)2+2NaOH—
Слайд 5
Самостоятельная работа
Na2CO3+Ca(OH)2→
Ba(NO3)2+K2SO4→
CaCO3⇄t°
NaHCO3⇄t°
Слайд 6
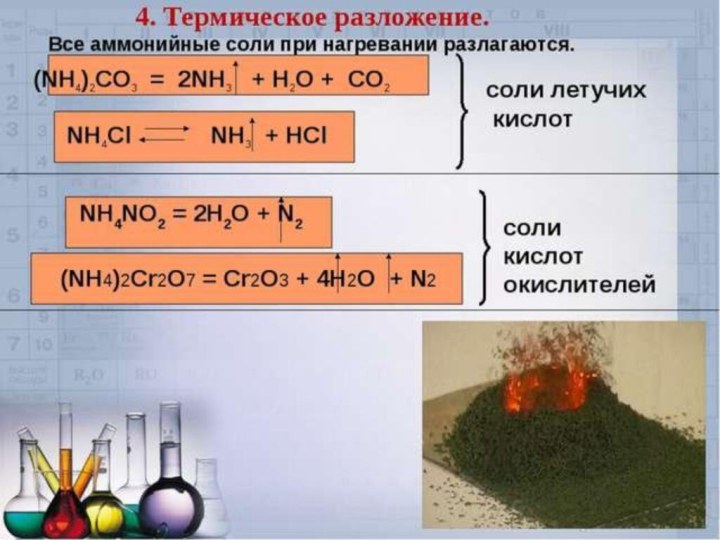
Термическое разложение солей
Многие соли устойчивы при нагревании, однако,
соли аммония, некоторые соли малоактивных металлов, слабых кислот и
кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
Слайд 9
При разложении карбонатов образуются оксид металла и углекислый
газ:
CaCO3 = CaO + CO2.
Если оксид металла неустойчив, то карбонат
разлагается на металл, углекислый газ и кислород:
2Ag2CO3 = 4Ag + 2CO2 + O2.
Слайд 11
Разложение нитратов
Соли аммония разлагаются с выделением аммиака:
NH4Cl =
NH3 + HCl.
Исключение составляют нитрат и нитрит аммония:
NH4NO3 = N2O +
2H2O,
NH4NO2 = N2 + 2H2O.
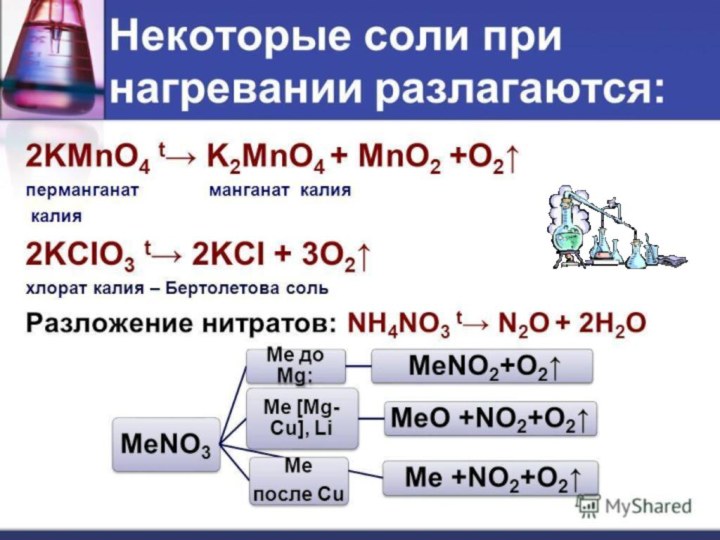
Разложение нитратов металлов.
Нитраты щелочных металлов разлагаются с образованием нитрита металла и кислорода:
2NaNO3 = 2NaNO2 + O2.
Слайд 12
Нитраты
Нитраты металлов, стоящих в ряду напряжений металлов между
водородом и алюминием, разлагаются с образованием оксида металла, оксида
азота (IV) и кислорода:
2Fe(NO3)2 = 2FeO + 4NO2 + O2.
Слайд 13
Нитраты
Нитраты малоактивных металлов, стоящих в ряду
напряжений после водорода (за исключением нитрата меди (II)), разлагаются
с образованием металла, оксида азота (IV) и кислорода:
2AgNO3 = 2Ag + 2NO2 + O2.
Слайд 14
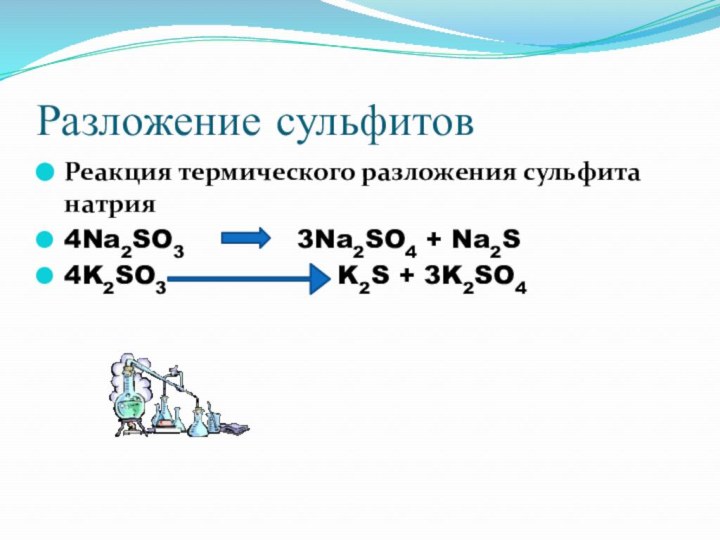
Разложение сульфитов
Реакция термического разложения сульфита натрия
4Na2SO3
3Na2SO4 + Na2S
4K2SO3
K2S + 3K2SO4
Слайд 15
Разложение сульфатов
Fe2(SO4)3 = Fe2O3 + 3SO3.
2BaSO4 → 2BaO + 2SO2 + O2
Условия: выше 1580 °C
Слайд 16
Задача
Задание Вычислите объем кислорода, выделяющийся при образовании сульфата
натрия по реакции взаимодействии пероксида натрия массой 47,5 г
с раствором серной кислоты.
Слайд 17
Решение
Уравнение реакции имеет следующий вид:2Na2O2 + 2H2SO4 = 2Na2SO4 +
2H2O + O2↑.
Рассчитаем количество моль пероксида натрия (молярная масса
равна 78 г/моль):
n = m / M;
n(Na2O2) = m (Na2O2) / M (Na2O2);
n (Na2O2) = 47,5 / 78 = 0,61 моль.
Согласно уравнению реакции n (Na2O2) : n (O2) = 2: 1. Значит,
n(O2) = ½ × n(Na2O2) = ½ × 0,61 = 0,305 моль.
Тогда, объем выделяющегося кислорода будет равен:
V = n × Vm;
V (O2) = n (O2) × Vm;
V (O2) = 0,305 × 22,4 = 6,832л.
Ответ Объем кислорода равен 6,832 л.
Слайд 18
Реакция термического разложения сульфата меди(II)
2CuSO4 2CuO + 2SO2 + O2
Реакция термического разложения сульфата меди(II) с образованием оксида
меди(II), оксида серы(IV) и кислорода. Реакция протекает при температуре 653-720°C. Примесь - оксид серы().
Слайд 19
Реакция разложения сульфата алюминия
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
Условия: 770 — 860
°C
В результате реакции разложения сульфата алюминия (Al2(SO4)3)
образуется оксид алюминия (Al2O3) и оксид серы (IV) (SO2) и кислород (O2)
Слайд 20
Реакция термического разложения сульфата свинца(II)
2PbSO4
2PbO +2SO2 +O2
Реакция термического
разложения сульфата свинца(II) с образованием оксида свинца(II), оксида серы(IV) и кислорода. Реакция протекает при температуре выше 1200°C.
Слайд 21
Реакция термического разложения сульфата цинка
2ZnSO4
2ZnO + 2SO2 + O2
Реакция
термического разложения сульфата цинка с образованием оксида цинка, оксида серы(IV) и кислорода. Реакция протекает при температуре 930-1000°C.
Слайд 22
Задание
При разложении основного карбоната меди (минерала малахита) CuCO3
× Cu (OH)2 образуется три оксида. Напишите уравнение этой
реакции.
Слайд 23
Ответ
Разложение малахита:
(CuOH)2CO3 = 2CuO + CO2 + H2O
Слайд 24
Подведение итогов урока
На уроке я узнал
Выполнил ____________заданий
Не понял___________
Было
интересно: