Слайд 2
Клатраты (от лат. clathratus - защищенный решеткой) (соединения
включения), образованы включением молекул, называемых "гостями", в полости кристаллического
каркаса, состоящего из молекул другого сорта, называемых "хозяевами" (решетчатые клатраты), или в полость одной большой молекулы-хозяина (молекулярные клатраты).
Среди решетчатых клатратов в зависимости от формы полости различают:
газовые гидраты,
клеточные (криптатоклатраты), например, клатраты гидрохинона,
канальные (тубулатоклатраты), например, клатраты мочевины и тиомочевины
слоистые (интеркалаты), например, соединения графита.
Молекулярные клатраты подразделяются на:
кавитаты, имеющие полость в виде канала или клетки, например, соединения циклодекстрина с I2 или амилазы с I2,
адикулаты, у которых полость напоминает корзину. Белковые клатраты называют клатринами.
Решетчатые клатраты существуют только в кристаллическом состоянии, молекулярные - также и в растворе. Часто не все полости хозяина заполнены молекулами гостя.
Слайд 7
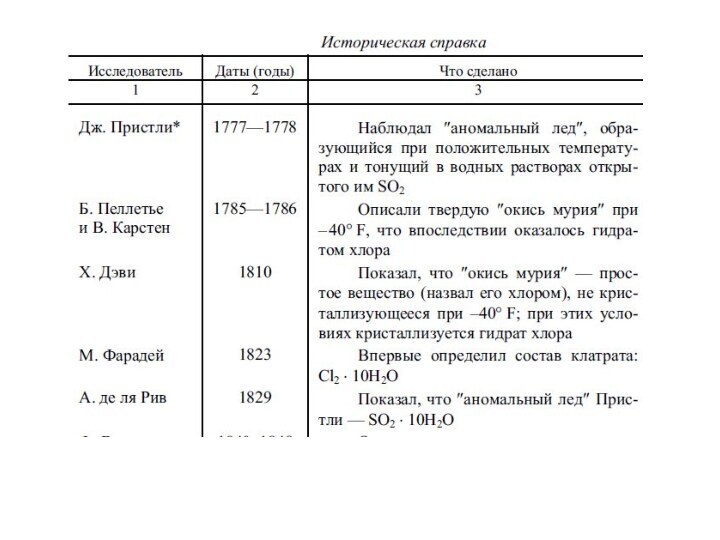
Исторический бэкграунд
Вещества, которые в настоящее время рассматривают как

соединения включения, первыми, по-видимому, наблюдали А. Кронстедт, открывший в
1756 г. цеолит стильбит (цеолит = кипящий камень), и Дж. Пристли, в 1778 г. обнаруживший «аномальный лед», оказавшийся гидратом SO2 х 10H2O ("аномальный лед" образовывался при положительных температурах в водном растворе открытого им же сернистого газа и тонул в нем.). В 1785 – 1786 гг. Б. Пелетье и В. Карстен, а в 1811 г. Г. Дэви наблюдали образование кристаллов при охлаждении газообразного хлора, впоследствии (в 1823 г.) М. Фарадей установил, что это Cl2.10H2O, однако структура данного гидрата была установлена лишь в 1952 г. М. Штакельбергом и Г. Мюллером.
(В. Карстен и Б. Пеллетье описали образование твердой "окиси мурия" при – 40 C. Хемфри Дэви (1810) установил, что "окись мурия" является простым веществом, которому дал название "хлор" (от греч. clwroz - зеленоватый), последний кристаллизуется при указанной температуре лишь при наличии паров воды, то есть является гидратом. )
Фридрих Вёлер (хорошо известный как первый исследователь, которому удалось синтезировать органическое вещество из неорганических) обнаружил в 1840 году гидрат Н2S х 6Н2О (это первый правильный состав гидрата, определенный с точностью нашего времени), а в 1848 году, восстанавливая хинон в гидрохинон, получил аддукт Н2S х 3С6Н4(ОН)2 и отметил, что это вещество имеет природу, аналогичную кристаллогидратной.
Слайд 8
В середине 30-х годов Б.А. Никитин сформулировал правило

аналогии: "Если два вещества обладают сходными ван-дер-ваальсовыми силами и
молекулы их сходны по размеру и форме, то они должны давать с третьим веществом аналогичные соединения, обладающие близкой устойчивостью и способные образовывать друг с другом смешанные кристаллы". Это правило имеет такое же значение для супрамолекулярной химии, как Периодический закон для традиционной. Пользуясь этим правилом, Никитин не только установил сам факт образования гидрата радона, соосаждая его с гидратами H2S х 6H2O и SO2 х 6H2O, но и оценил его состав и устойчивость. Таким же образом он охарактеризовал соединение радона с фенолом, соосаждая его с другими открытыми им же клатратами фенола.
В 1948 г. Пауэлл опубликовал основополагающую работу, в которой впервые ввел термин ″клатрат″ и сформулировал новый принцип образования соединения между двумя компонентами — не за счет химических связей, а за счет их пространственной комплементарности.
Исследуя структуры соединений гидрохинона с летучими компонентами (такими, как SO2 , HCl, HBr, Ar, Xe), Пауэлл обратил внимание на то, что они изоструктурны и состоят из существенно различных подсистем: относительно жесткой каркасной подсистемы из связанных водородными связями молекул гидрохинона (они были названы им молекулами-хозяевами) с полостями молекулярного размера, в которых и располагаются упомянутые выше молекулы гостей.
Слайд 9
Einschlussverbindungen
В 1949 году В. Шленком введен термин "соединения
включения" (СВ) (Einschlussverbindungen) для канальных соединений мочевины и тиомочевины.
Первое время термин "клатрат" применялся только для клеточных соединений включения. В настоящее время наряду с термином "соединения включения" он используется независимо от формы полости и указывает на то, что между гостем и хозяином нет никаких специфических химических взаимодействий.
Слайд 10
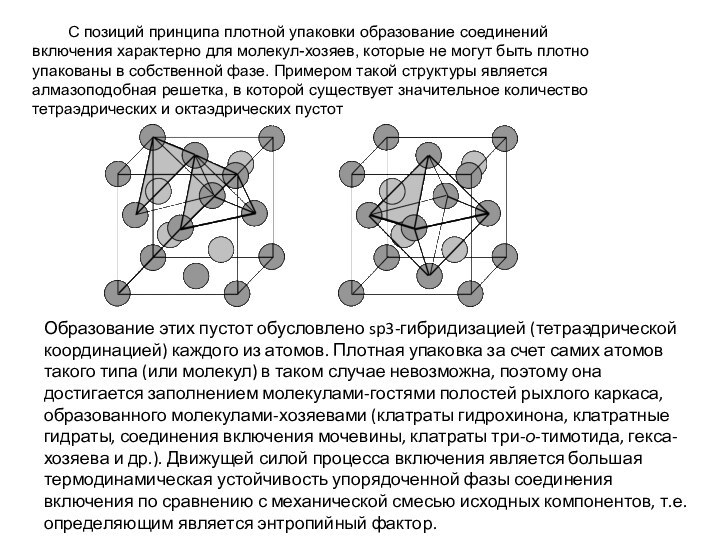
С позиций принципа плотной упаковки образование соединений включения
характерно для молекул-хозяев, которые не могут быть плотно упакованы
в собственной фазе. Примером такой структуры является алмазоподобная решетка, в которой существует значительное количество тетраэдрических и октаэдрических пустот
Образование этих пустот обусловлено sp3-гибридизацией (тетраэдрической координацией) каждого из атомов. Плотная упаковка за счет самих атомов такого типа (или молекул) в таком случае невозможна, поэтому она достигается заполнением молекулами-гостями полостей рыхлого каркаса, образованного молекулами-хозяевами (клатраты гидрохинона, клатратные гидраты, соединения включения мочевины, клатраты три-о-тимотида, гекса-хозяева и др.). Движущей силой процесса включения является большая термодинамическая устойчивость упорядоченной фазы соединения включения по сравнению с механической смесью исходных компонентов, т.е. определяющим является энтропийный фактор.
Слайд 11
Наиболее благоприятные для образования клатратов характеристики хозяина -
объемность и направленность связей при малых координационных числах атомов,
их образующих (например, в каркасах из тетраэдрических группировок). Поскольку длины связей Si—О—Si и О—Н—О приблизительно одинаковы, гости в клатратном гидрате и в клатрате на основе SiO2 (клатрасил) могут быть одними и теми же. Например, известны клатратный гидрат и клатрасил метана кубической сингонии (а = 1,2 нм); но различаются эти соединения термической устойчивостью. Клатраты аналогичных структур образуют Ge и Si (алмазоподобная модификация) со щелочными металлами.
Известны клатраты на основе комплексных соединений, например, в соединении Шеффера [Cd(4-CH3C5H4N)4(NCS)2]х0,67(4-CH3C5H4N)х0,33H2O 4-метилпиридин является одновременно и лигандом и гостем.
Слайд 12
Способность гостя к клатратообразованию в основном определяется размером

и формой его молекул, а не их химической природой.
Если внедряемые молекулы по размерам намного меньше размера полости, то энергии дисперсионных взаимодействий может быть недостаточно для стабилизации таких соединений. Так, водород (Н2) вообще не образует клатратов, а при увеличении размеров атомов при переходе от аргона к ксенону давление, при котором образуются гидраты, уменьшается от 1.013·107 Па до 1.013·105 Па при 0оС, а для хлора в тех же условиях требуется еще вдвое меньшее давление.
Гостями могут быть как молекулы, так и ионы. Например, в клатратном гидрате (изо-C5H11)4NF х 38H2O гость-катион, а хозяин - каркас, построенный из молекул воды и анионов F-. В гидрате HPF6 х 6H2O гость - анион PF- . Если каркас хозяина имеет полости разного типа, то возможно включение двух или нескольких типов гостей одновременно. Частичное или полное заполнение полостей гостями подходящего размера приводит к дополнит. стабилизации клатратного каркаса. Например, Тпл. клатратного гидрата ТГФ х 17Н2О равна 5.1 °С, а двойного гидрата ТГФ х Н2S х 17Н2О выше на 16 градусов - 21.3 oС.
6
Слайд 13
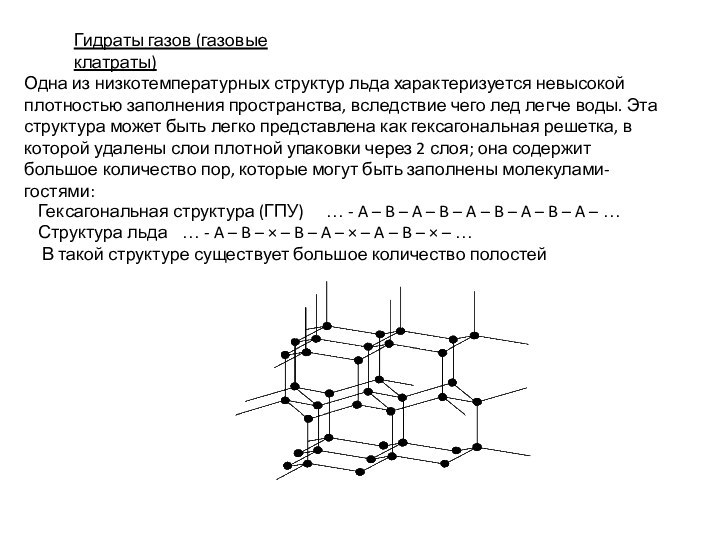
Гидраты газов (газовые клатраты)
Одна из низкотемпературных структур льда
характеризуется невысокой плотностью заполнения пространства, вследствие чего лед легче
воды. Эта структура может быть легко представлена как гексагональная решетка, в которой удалены слои плотной упаковки через 2 слоя; она содержит большое количество пор, которые могут быть заполнены молекулами-гостями:
Гексагональная структура (ГПУ) … - A – B – A – B – A – B – A – B – A – … Структура льда … - A – B – × – B – A – × – A – B – × – …
В такой структуре существует большое количество полостей
Слайд 14
Однако в случае воды (льда) в образовании клатратов

чаще участвуют другие метастабильные модификации льда - кубические и
более рыхлые (плотность 0.79 г/см3), чем обычная. Тетраэдрическая координация в структуре льда и гибкость водородной связи по длине и углу позволяют строить из молекул воды рыхлые и близкие по энергии структуры, из которых наиболее устойчивой при обычных условиях является структура льда Ih (обычный лед). В ней все длины связей и углы между ними практически одинаковы и равны 2,76 Å и 109,5о. Но, несмотря на связанный с этим очень низкий для твердого тела коэффициент упаковки (k = 0,43; напомним, что при плотнейшей упаковке шарообразных молекул одного размера k = 0,74), полости в этой структуре невелики и могут включать в себя разве лишь такие малые молекулы, как Н2 и Не.
Более рыхлые модификации льда образуются при кристаллизации воды в присутствии достаточного количества некоторых газов. Одна из таких модификаций на каждые 46 молекул H2O содержит 6 пустот с диаметром 5.9 Å и 2 пустоты с диаметром 5.2 Å. Заполнение всех пустот молекулами газа (X) приводит к составу Х х 5.75Н2О, а заполнение только более крупных – к составу Х·767Н2О. Другая (реже встречающаяся) структура на каждые 136 молекул воды содержит 8 пустот размером 6.9 Å и 16 пустот с диаметром 4.8 Å. Заполнение всех пустот этой структуры приводит к составу Х·5.67Н2О, а заполнение только крупных – к составу Х·17Н2О.
Слайд 15
Каждая включенная в пустоту той или иной структуры
частица Х оказывается окруженной очень большим числом (10 –
28) молекул Н2О, т.е. попадает как бы в «клетку», образованную этими молекулами. Благодаря аддитивности дисперсионных сил общая энергия взаимодействия между подходящими по объему Х и окружающими молекулами воды оказывается довольно значительным (порядка 25 – 420 кДж/моль Х), что определяет устойчивость рыхлых структур, которые сами по себе неустойчивы. Характерной особенностью таким продуктов соединения является определяющая роль структурных возможностей «вещества-хозяина» (льда), тогда как «вещество-гость» (например, инертный газ) включается лишь в меру этих возможностей. В общем случае состав клатратов может быть переменным, но существует предел по количеству захваченного вещества.
В отличие от льда клатраты обладают большей плотностью по сравнению даже с водой, поэтому оказываются на дне.
Слайд 16
Обычно гидраты газов описываются округленными формулами - Х·6Н2О
и Х·8Н2О. Как правило, они принадлежат к первому типу
(Х·5.75Н2О). Гидраты эти весьма неустойчивы, что видно из приводимых в таблице температур, при которых давление диссоциации достигает 1.013 кПа.
Температура разложения гидратов газов
Таблица1
Х Ar Kr Xe CH4 PH3 N2O CO2
ТоС -43 -28 -3 -29 -6 -19 -24
Состав аддуктов не связан с химическими особенностями «гостя», что нельзя отнести к его размеру или форме. Так, метан, пропан и изобутан образуют клатраты, тогда как для н-бутана и других нормальных углеводородов клатраты не получены
Слайд 17
Составы типа Х•17Н2О более характерны для включаемых в
лед молекул жидкости. Примером может служить кристаллический гидрат хлороформа
CHCl3•17H2O.
Газовые гидраты являются твердыми кристаллические веществами, внешним видом напоминающие снег или рыхлый лед. Вследствие отсутствия сильных химических взаимодействий гидратообразующие вещества, будучи, заключенными в водный клатратный каркас, в основном сохраняют свою химическую индивидуальность, равно как и вода. Так, гидрат природного газа горюч – при его горении создается впечатление пылающего комка снега, а после сгорания газа остается лужица воды.
Слайд 18
Клатраты мочевины
Простая органическая молекула, мочевина, как и ее
серосодержащий аналог, тиомочевина, образуют твердые клатраты с длинноцепными углеводородами
типа н- алканов. Мочевина способна действовать как хозяин благодаря сильным межмолекулярным водородным связям между кислотными протонами NH2-групп и атомами кислорода или серы соседних молекул. В результате образуется хиральная спиральная полая трубка из молекул мочевины с минимальным ван-дер-ваальсовым диаметром 5.5 - 5.8 Å, в которую могут войти гости с малым поперечным сечением. Такое спиральное расположение позволяет каждой молекуле мочевины образовывать водородные связи со всеми ее NH-протонами, максимизируя межмолекулярные взаимодействия. Это означает, что каждый атом кислорода (или серы) должен принять всего четыре водородные связи. Сходные, но большие каналы образует тиомочевина, что позволяет включать разветвленные углеводороды, но не небольшие н-алканы
Слайд 19
Удаление гостя (например, внешним вакуумом) приводит к немедленному

разрушению каналов и образованию тетрагональной мочевины, неспособной к включению
и имеющей совершенно другую структуру.
Одна из главных причин интереса к соединениям включения мочевины состоит в их возможном применении для разделения линейных и разветвленных углеводородов в нефтехимической промышленности. Поскольку диаметр канала лишь ненамного превышает ван-дер-ваальсов диаметр сечения линейной углеводородной цепи, для осуществления реакции включения допустимо лишь незначительное разветвление. Возможность мочевины образовывать данное соединение включения можно просто оценить, сравнивая размер канала с диаметром соответствующего гостя. Например, найдено, что молекула бензола шире, чем канал, и включение происходит с трудом. Интересно, однако, что увеличение длины цепи допускает наличие больших, более разветвленных концевых групп. Так, 1-фенилоктан в качестве гостя не образует соединения включения, а намного более длинный 1-фенилэйкозан дает его. Измерение равновесного давления пара показало, что энтальпия комплексообразования возрастает примерно на 10.0 кДж·моль-1 при увеличении линейной цепи на одну СН2-группу. Следовательно, дополнительная стабилизация, достигаемая при комплексообразовании более длинного гостя, перевешивает неблагоприятные стерические взаимодействия с концевой фенильной группой. В общем алкановые молекулы-гости проявляют одномерное упорядочение, располагаясь вдоль канала мочевины, но структура в одном канале никак не соотносится со структурой в соседних каналах.