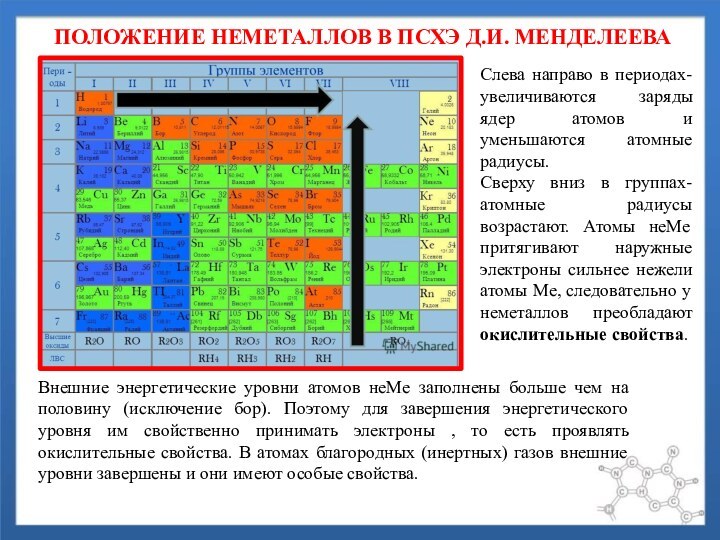
периодах- увеличиваются заряды ядер атомов и уменьшаются атомные радиусы.
Сверху
вниз в группах- атомные радиусы возрастают. Атомы неМе притягивают наружные электроны сильнее нежели атомы Ме, следовательно у неметаллов преобладают окислительные свойства.Внешние энергетические уровни атомов неМе заполнены больше чем на половину (исключение бор). Поэтому для завершения энергетического уровня им свойственно принимать электроны , то есть проявлять окислительные свойства. В атомах благородных (инертных) газов внешние уровни завершены и они имеют особые свойства.