Слайд 2
КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ
КЩР определенное соотношение
концентрации протонов водорода Н+ и гидроксильных
анионов (ОН-) в биологических средах организма
Когда увеличивается содержание протонов водорода, говорят об ацидозе
Когда увеличивается содержание гидроксильных анионов, говорят об алкалозе
Слайд 3
КОНЦЕНТРАЦИЯ Н+ ВО ВНЕКЛЕТОЧНОЙ
ЖИДКОСТИ СОСТАВЛЯЕТ ОДНУ МИЛЛИОННУЮ ОТ СОДЕРЖАНИЯ НАТРИЯ
Врачи, как
правило, соглашаются с важностью понимания расстройств КЩР, но сопротивляются пониманию научной части патологии и области ее применения
рН является наиболее жесткой физикохимической константой. Концентрация Н+ во внеклеточной жидкости составляет одну миллионную от содержания натрия и калия, а регуляция на два порядка точнее
Слайд 4
ЗНАЧЕНИЕ ПОСТОЯНСТВА КЩР ДЛЯ ОРГАНИЗМА
1) рН определяет физикохимические
свойства коллоидных структур
2) рН определяет активность, конформацию белков
3) рН
определяет чувствительность клеточных рецепторов
4) рН определяет проницаемость клеточных мембран
4) рН регулирует сосудистый тонус
5) рН определяет состояние дыхательного центра
6) рН влияет на состояние ЦНС
Слайд 5
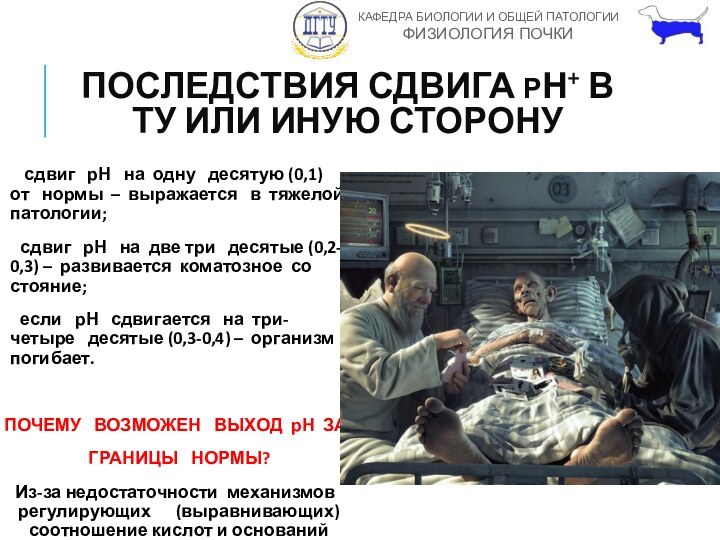
ПОСЛЕДСТВИЯ СДВИГА РН+ В ТУ ИЛИ ИНУЮ СТОРОНУ
сдвиг рН на одну десятую
(0,1) от нормы – выражается в тяжелой патологии;
сдвиг рН на две три десятые (0,2-0,3) – развивается коматозное состояние;
если рН сдвигается на три-четыре десятые (0,3-0,4) – организм погибает.
ПОЧЕМУ ВОЗМОЖЕН ВЫХОД рН ЗА
ГРАНИЦЫ НОРМЫ?
Из-за недостаточности механизмов регулирующих (выравнивающих) соотношение кислот и оснований
Слайд 6
МЕХАНИЗМЫ ПОДДЕРЖАНИЯ КЩР
Выделяют два основных механизма, обеспечивающих уравновешивание
кислых ионов:
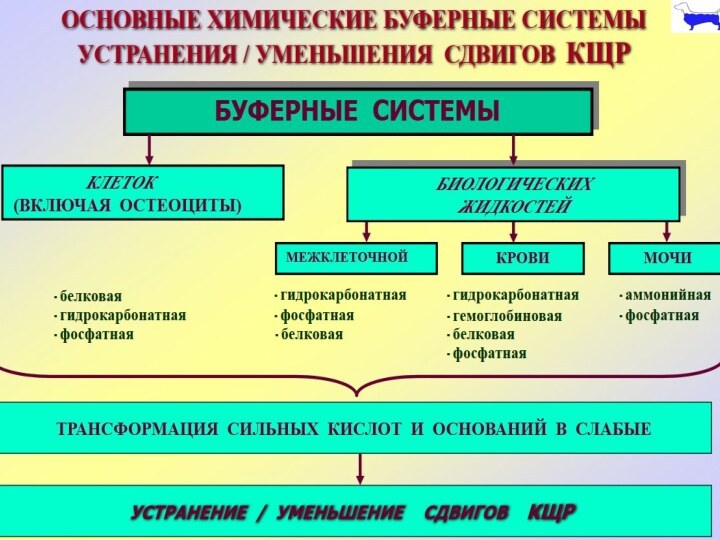
1. Химические буферные системы крови и тканей
2. Физиологические
буферные системы (дыхание и почечная регуляция)
Слайд 7
ХИМИЧЕСКИЕ БУФЕРНЫЕ СИСТЕМЫ КРОВИ И ТКАНЕЙ
Слайд 8
ГИДРОКОРБОНАТНЫЙ БУФЕР
[H+]=24×(pCO2):[HCO3-]
УРАВНЕНИЕ Гендерсона-Хассельбаха
=
Слайд 9
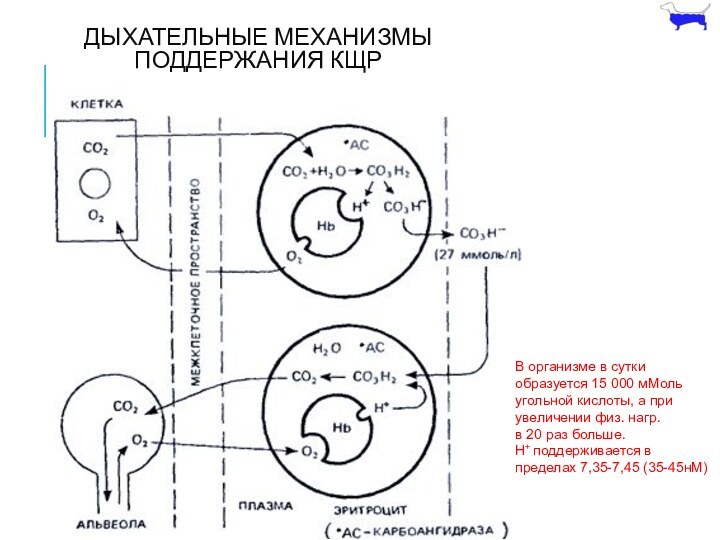
ДЫХАТЕЛЬНЫЕ МЕХАНИЗМЫ ПОДДЕРЖАНИЯ КЩР
В организме в сутки
образуется 15
000 мМоль
угольной кислоты, а при
увеличении физ. нагр.
в 20
раз больше.
H+ поддерживается в
пределах 7,35-7,45 (35-45нМ)
Слайд 10
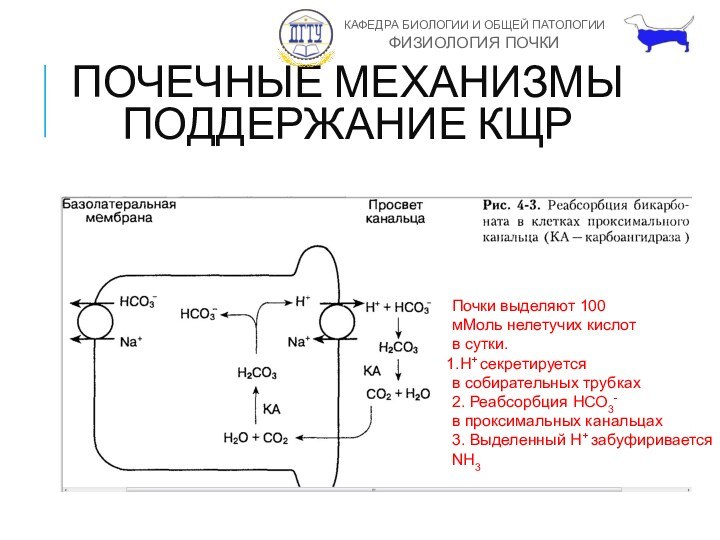
ПОЧЕЧНЫЕ МЕХАНИЗМЫ ПОДДЕРЖАНИЕ КЩР
Почки выделяют 100
мМоль нелетучих кислот
в
сутки.
H+ секретируется
в собирательных трубках
2. Реабсорбция HСО3-
в проксимальных
канальцах
3. Выделенный H+ забуфиривается
NH3
Слайд 11
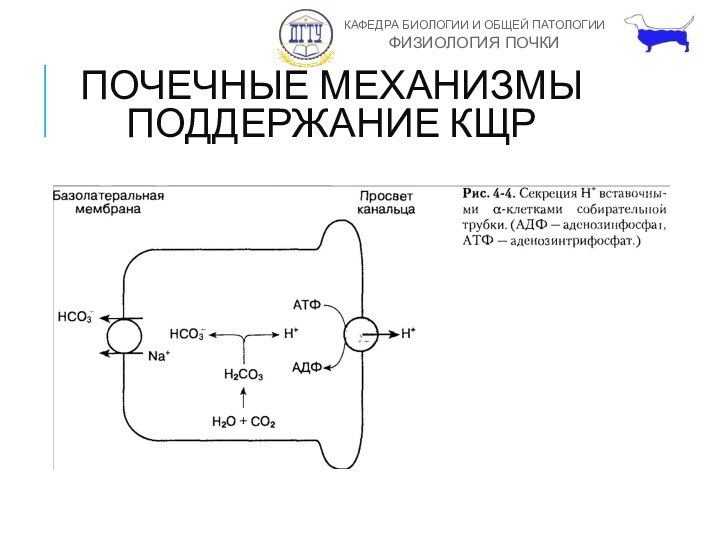
ПОЧЕЧНЫЕ МЕХАНИЗМЫ ПОДДЕРЖАНИЕ КЩР
Слайд 12
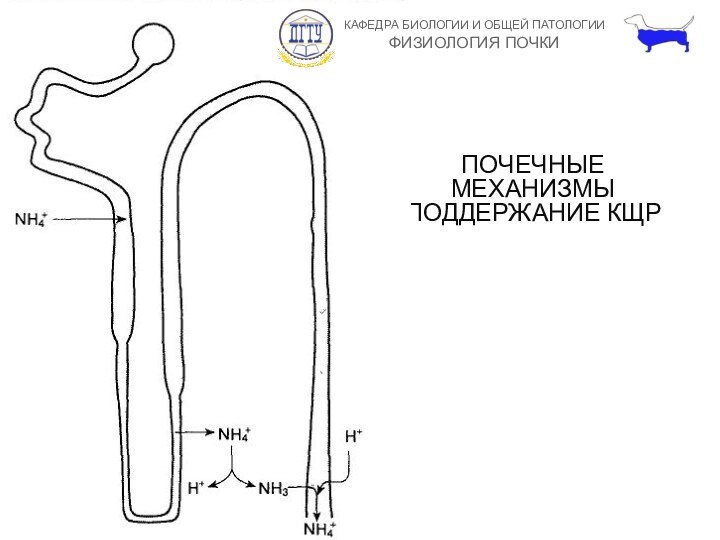
ПОЧЕЧНЫЕ МЕХАНИЗМЫ ПОДДЕРЖАНИЕ КЩР
Слайд 13
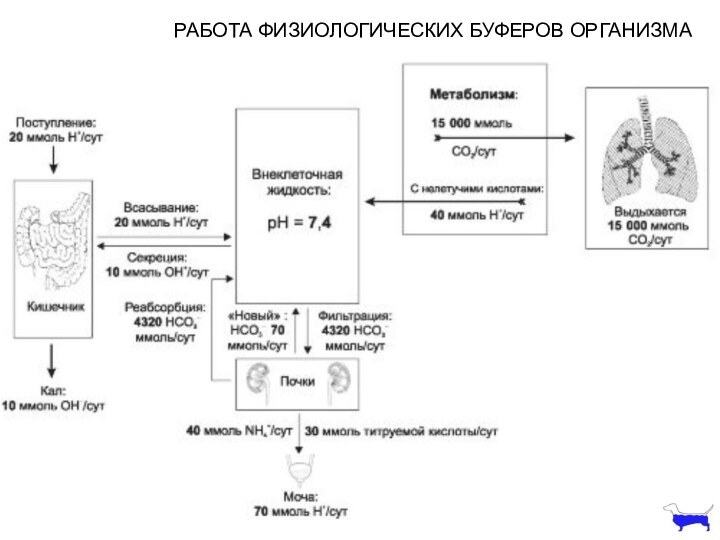
РАБОТА ФИЗИОЛОГИЧЕСКИХ БУФЕРОВ ОРГАНИЗМА
Слайд 14
КИСЛОТНОСТЬ (PH)
pH 7,4±0,04
(норма) 7,36-7,44
Ацидоз (ацидемия) pH
pH>7,45
4!
Слайд 15
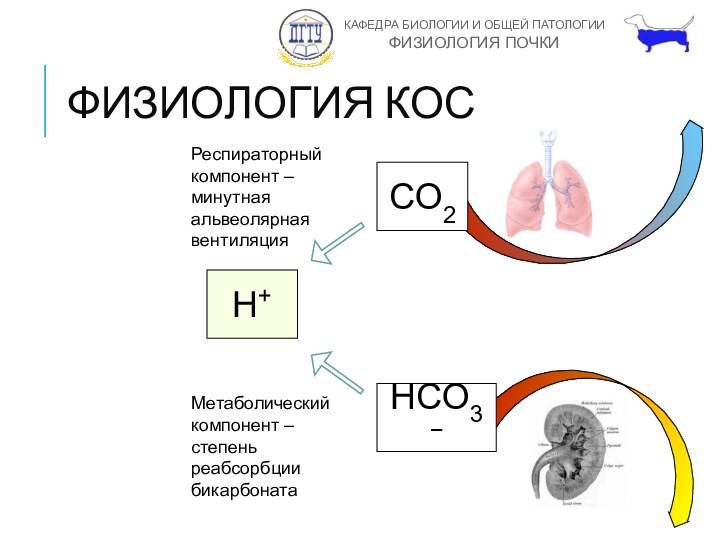
ФИЗИОЛОГИЯ КОС
CO2
H+
HCO3−
Респираторный компонент – минутная альвеолярная вентиляция
Метаболический компонент
– степень реабсорбции бикарбоната
Слайд 17
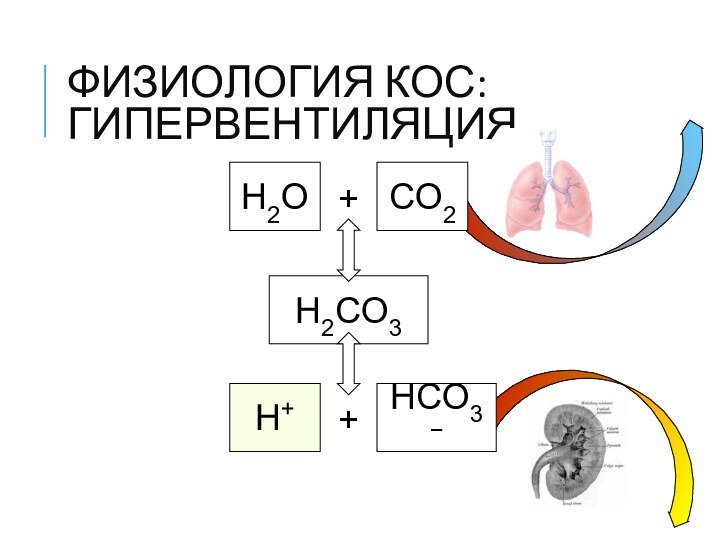
ФИЗИОЛОГИЯ КОС: ГИПЕРВЕНТИЛЯЦИЯ
H2O
+
CO2
H2CO3
H+
+
HCO3−
Слайд 18
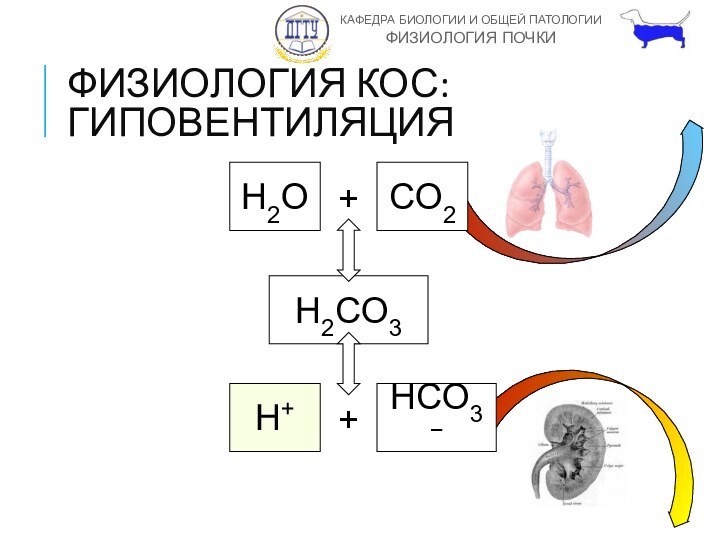
ФИЗИОЛОГИЯ КОС: ГИПОВЕНТИЛЯЦИЯ
H2O
+
CO2
H2CO3
H+
+
HCO3−
Слайд 19
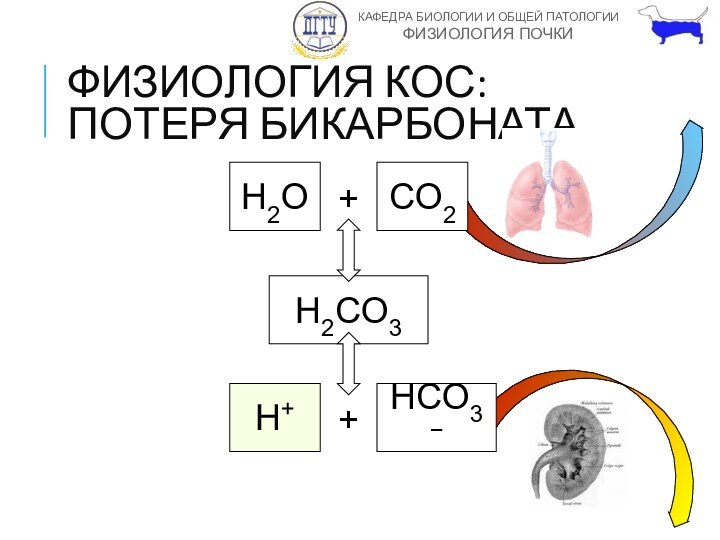
ФИЗИОЛОГИЯ КОС:
ПОТЕРЯ БИКАРБОНАТА
H2O
+
CO2
H2CO3
H+
+
HCO3−
Слайд 20
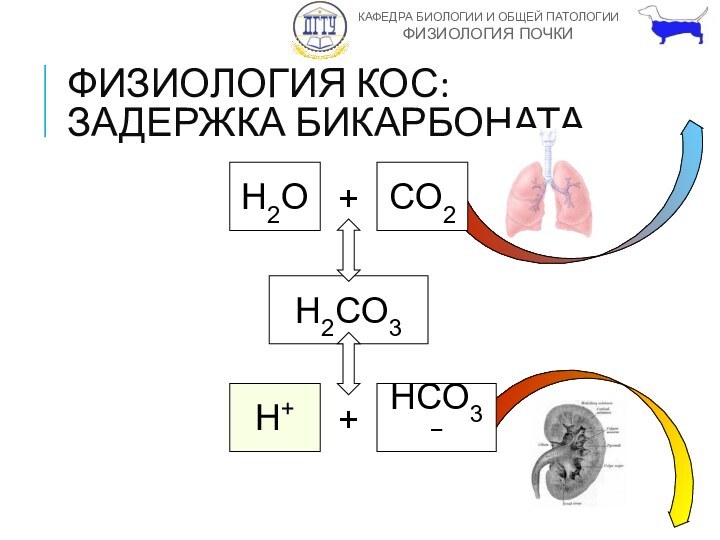
ФИЗИОЛОГИЯ КОС: ЗАДЕРЖКА БИКАРБОНАТА
H2O
+
CO2
H2CO3
H+
+
HCO3−
Слайд 21
Бикарбонат – это сода (щелочная реакция)
Протоны H+ -
это кислота
их источник в том числе и H2CO3
Слайд 22
НОРМЫ
pH 7,4±0,04
pCO2 40±4 мм рт. ст.
HCO3− 24±4 ммоль/л
4!
Слайд 23
РЕСПИРАТОРНЫЙ КОМПОНЕНТ:
ВЕНТИЛЯЦИЯ
Оценивается по CO2
Прямо пропорциональна минутной альвеолярной вентиляции
(л/мин)
Чем больше вентилиция, тем меньше pCO2
Зависит от:
Респираторного драйва, нервно-мышечной
передачи и дыхательной мускулатуры
Проходимость дыхательных путей
Состояния плевральной полости и каркаса грудной клетки
Вентиляционно-перфузионного отношения
Слайд 24
МЕТАБОЛИЧЕСКИЙ КОМПОНЕНТ: КОНЦЕНТРАЦИЯ БИКАРБОНАТА
Оценивается по HCO3- и BE
(щелочной резерв)
Зависит от:
Реабсорбции/задержки бикарбоната почками
Появления кислот, диссоциирующих на анион
и H+, связывающий бикарбонат
Потерь бикарбоната с экссудатами и мочой
Слайд 25
ФИЗИОЛОГИЯ НАРУШЕНИЯ КОС
Первичное нарушение приводит к сдвигу pH
Вторичное
нарушение является компенсаторным, направлено в противоположную сторону
Слайд 26
ПОНЯТИЕ КОМПЕНСАЦИИ И ДЕКОМПЕНСАЦИИ
Компенсация – pH в норме,
а
pCO2 и HCO3− изменены - хронический или медленный процесс,
в ОРИТ встречается реже
Декомпенсация – наличие сдвига pH, в ОРИТ встречается чаще
Слайд 27
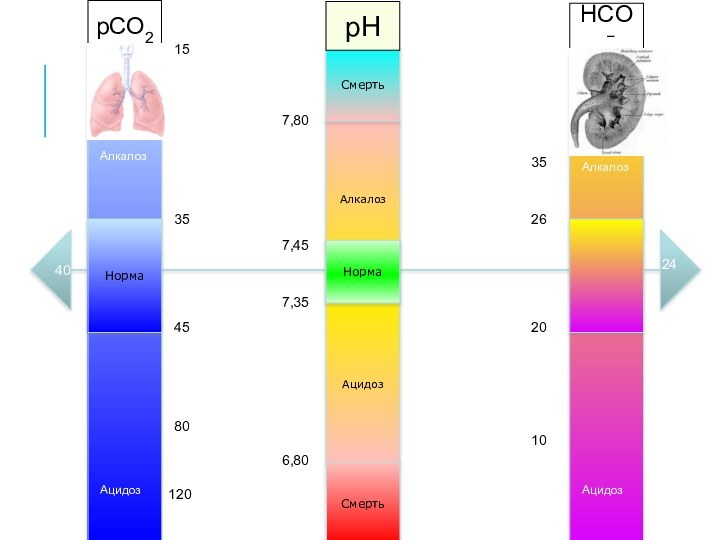
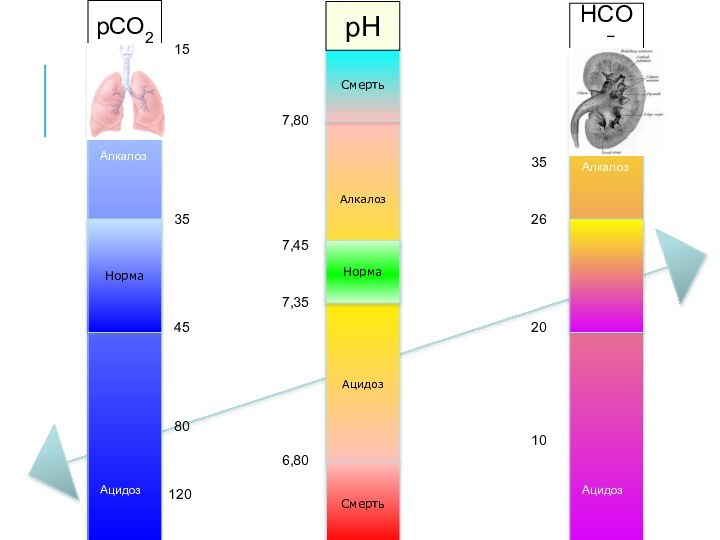
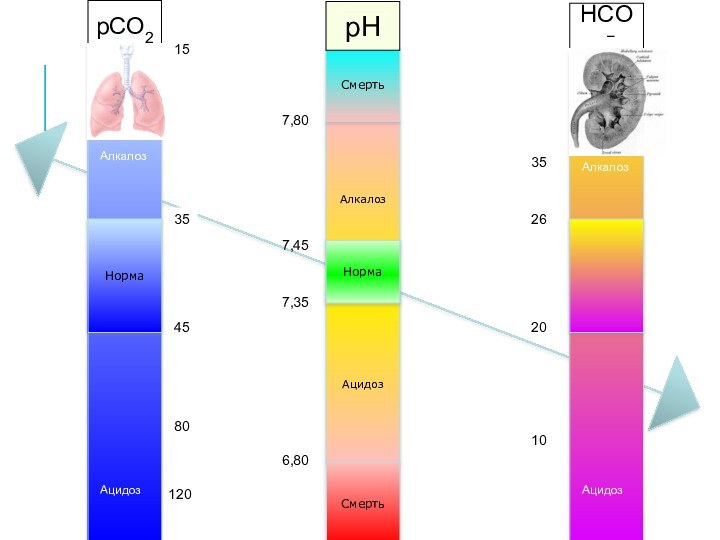
Алкалоз
Ацидоз
Норма
Смерть
Смерть
7,35
7,45
6,80
7,80
Норма
pCO2
pH
HCO3−
35
45
80
120
25
20
26
24
40
15
35
10
Алкалоз
Ацидоз
Алкалоз
Ацидоз
Слайд 28
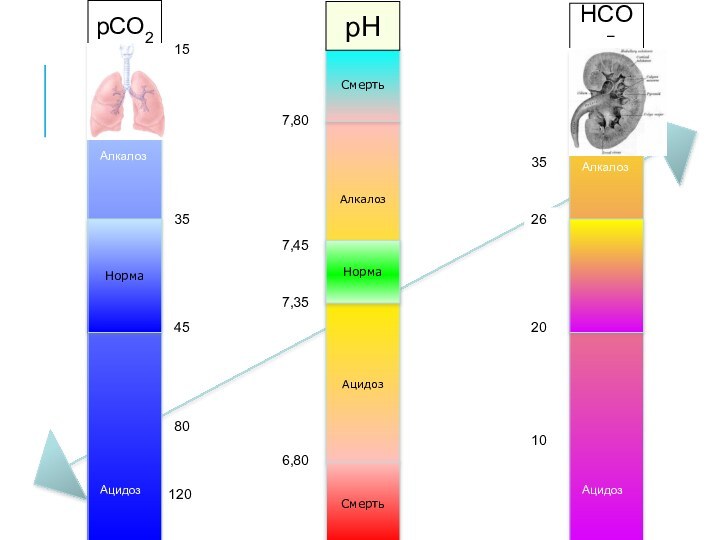
Алкалоз
Ацидоз
Норма
Смерть
Смерть
7,35
7,45
6,80
7,80
Норма
pCO2
pH
HCO3−
35
45
80
120
25
20
26
40
15
35
10
Алкалоз
Ацидоз
Алкалоз
Ацидоз
Слайд 29
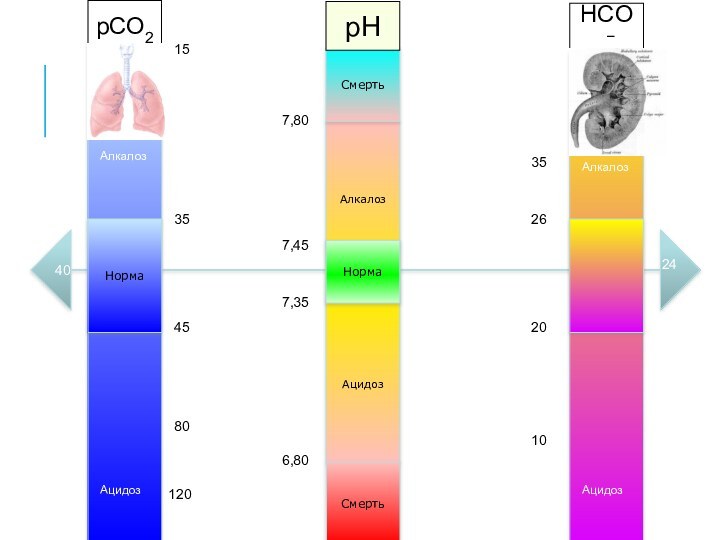
Алкалоз
Ацидоз
Норма
Смерть
Смерть
7,35
7,45
6,80
7,80
Норма
pCO2
pH
HCO3−
35
45
80
120
25
20
26
40
15
35
10
Алкалоз
Ацидоз
Алкалоз
Ацидоз
Слайд 30
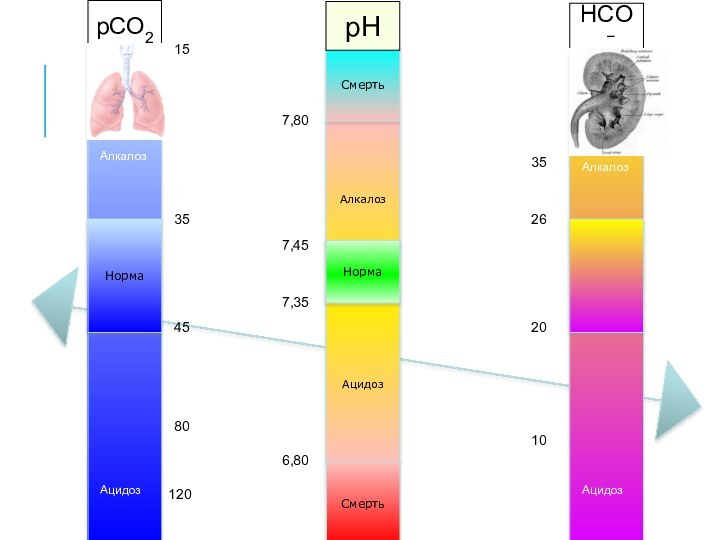
Алкалоз
Ацидоз
Норма
Смерть
Смерть
7,35
7,45
6,80
7,80
Норма
pCO2
pH
HCO3−
35
45
80
120
25
20
26
24
40
15
35
10
Алкалоз
Ацидоз
Алкалоз
Ацидоз
Слайд 31
Алкалоз
Ацидоз
Норма
Смерть
Смерть
7,35
7,45
6,80
7,80
Норма
pCO2
pH
HCO3−
35
45
80
120
25
20
26
24
15
35
10
Алкалоз
Ацидоз
Алкалоз
Ацидоз
Слайд 32
Алкалоз
Ацидоз
Норма
Смерть
Смерть
7,35
7,45
6,80
7,80
Норма
pCO2
pH
HCO3−
35
45
80
120
25
20
26
24
15
35
10
Алкалоз
Ацидоз
Алкалоз
Ацидоз
Слайд 33
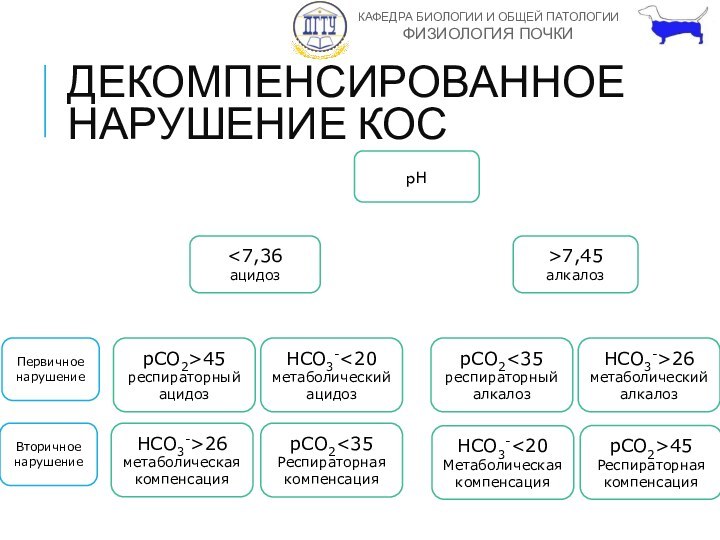
ДЕКОМПЕНСИРОВАННОЕ НАРУШЕНИЕ КОС
pH
7,45
алкалоз
pCO2>45
респираторный ацидоз
HCO3-26
метаболическая компенсация
Первичное
нарушение
Вторичное нарушение
HCO3-45
Респираторная компенсация
pCO2
Слайд 34
ПЕРВИЧНОЕ НАРУШЕНИЕ
Что приводит к сдвигу pH?
Респираторный (pCO2) компонент
или
Метаболический
(HCO3−) компонент?
pH 7,30
pO2 130
pCO2 25
HCO3− 10
BE -10
SpO2 100
K 4,1
Na 133
Cl 115
Hb 140
Htc 40%
Слайд 35
ВТОРИЧНОЕ НАРУШЕНИЕ (КОМПЕНСАЦИЯ)
Что старается вернуть pH в норму?
Респираторный
(pCO2) компонент
или
Метаболический (HCO3−) компонент?
pH 7,30
pO2 130
pCO2 25
HCO3− 10
BE -10
SpO2 100
K 4,1
Na 133
Cl 115
Hb 140
Htc 40%
Слайд 36
ЩЕЛОЧНОЙ РЕЗЕРВ (BE)
Oтражает метаболический компонент КЩС при нормальных
условиях
(давление 1 атм, paCO2=40)
Количество ммоль кислоты или основания,
которые необходимо
добавить к 1 л крови,
чтобы pH вернулось в норму
Норма BE: 0…+2
BE = 0,9287 [HCO3 – 24,4 + 14,83 (pH – 7,4)]
Слайд 37
ИНТЕРПРЕТАЦИЯ BE
Норма − 0±4 (обычно +2)
“-” − метаболический
ацидоз или компенсация
“+” − метаболический алкалоз или компенсация
Слайд 38
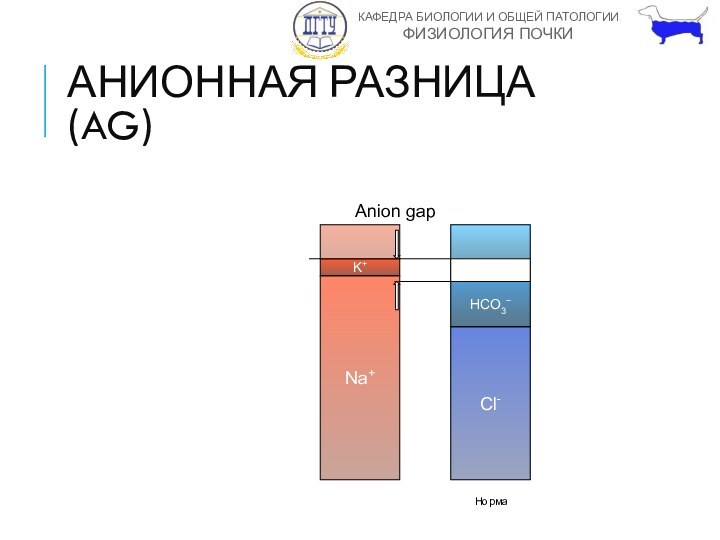
АНИОННАЯ РАЗНИЦА
(ANION GAP)
Разница между неизмеряемыми анионами и катионами
AG=(Na+
+ K+) - (HCO3−+Cl−)
Позволяет увидеть появление дополнительного неизмеряемого аниона
Слайд 39
АНИОННАЯ РАЗНИЦА (AG)
Na+
K+
Неизмер.
Анионы
Катионы
160
мЭкв/л
Cl-
HCO3−
Неизмер.
Сульфаты
Фосфаты
Белки
Органические кислоты
Ca2+
Mg2+
Слайд 41
ГИПЕРХЛОРЕМИЧЕСКИЙ АЦИДОЗ – ПРИ ПОТЕРЕ HCO3-
Cl-
HCO3−
Гиперхлоремический
Слайд 42
НОРМОХЛОРЕМИЧЕСКИЙ АЦИДОЗ – ПРИ ПОЯВЛЕНИИ НЕИЗМЕРЯЕМОГО АНИОНА
Cl-
HCO3−
Cl-
HCO3−
Гиперхлоремический
Нормохлоремический
Слайд 43
НОРМА AG
Человеки 8-12 мЭкв/л
Собаки 12-24 мЭкв/л
Кошки 13-27 мЭкв/л
такая
разница потому, что у животных белки имеют бóльший заряд,
чем у человека
Слайд 44
СНИЖЕНИЕ AG
Гипопротеинемия
Снижение общего белка на 10 г/л снижает
AG на 2,5 мЭкв/л
Гипоальбуминемия
Снижение альбумина на 10 г/л снижает
AG на 4,1 мЭкв/л
Слайд 46
РЕСПИРАТОРНЫЙ АЦИДОЗ
Неэффективная вентиляция и/или перфузия легких
ЦНС, n. phrenicus,
дыхательные
мышцы
Воздухоносные пути
Плевральная полость,
грудная стенка, диафрагма
pH 7,28
pO2 60
pCO2 78
HCO3− 29
BE -4
SpO2 90
K 6,2
Na 155
Cl 108
Hb 155
Htc 49%
Слайд 47
РЕСПИРАТОРНЫЙ АЛКАЛОЗ
Тахипноэ
Повреждения ЦНС
Возбуждение
Лихорадка, гипертермия
Ятрогенное тахипноэ при ИВЛ
Эклампсия
pH 7,51
pO2 100
pCO2 20
HCO3− 19
BE +5
SpO2 100
K 3,2
Na 147
Cl 111
Hb 140
Htc 40%
Слайд 48
МЕТАБОЛИЧЕСКИЙ АЦИДОЗ
Потери бикарбоната (гиперхлоремический)
Введение H+ и связывание бикарбоната
(нормохлоремический)
Дифференцируем по анионной разнице, уровню хлора и клинической картине
Слайд 49
АЦИДОЗ С УВЕЛИЧЕНИЕМ AG
(НОРМОХЛОРЕМИЧЕСКИЙ)
H+ связывает бикарбонат
Увеличиваются неизмеряемые анионы
Лактат-ацидоз
Шок
Серьезная
гипоксемия
Генерализованные судороги
Тяжелый сепсис
pH 7,25
pO2 100
pCO2 33
HCO3− 15
BE -8
SpO2 100
K 6,6
Na 155
Cl 109
Hb 138
Htc 37%
Слайд 50
АЦИДОЗ С УВЕЛИЧЕНИЕМ AG (НОРМОХЛОРЕМИЧЕСКИЙ)
Парентеральное питание (избыток аминокислот)
Уремические
токсины
Кетоацидоз
Отравление
Метанол
Этиленгликоль
Паральдегид
Салицилаты
pH 7,25
pO2 100
pCO2 33
HCO3− 15
BE -8
SpO2 100
K 6,6
Na 155
Cl 109
Hb 138
Htc 37%
Слайд 51
АЦИДОЗ БЕЗ УВЕЛИЧЕНИЯ AG (ГИПЕРХЛОРЕМИЧЕСКИЙ)
Потери бикарбоната, компенсируются повышением
Cl-
Через ЖКТ
Диарея
Панкреат. или билиарн. фистула
Через почки
Компенсация респ. алкалоза
Канальцевый некроз
Гипоперфузия
почек
Ингибиторы карбоангидразы
Ятрогенный
pH 7,30
pO2 85
pCO2 23
HCO3− 11
BE -6
SpO2 100
K 3,5
Na 141
Cl 130
Hb 140
Htc 40%




![Анализ кислотно-основного состояния крови ГИДРОКОРБОНАТНЫЙ БУФЕР[H+]=24×(pCO2):[HCO3-]УРАВНЕНИЕ Гендерсона-Хассельбаха =](/img/tmb/15/1431024/385f3fbe6c5d0890733fb22193322779-720x.jpg)