- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
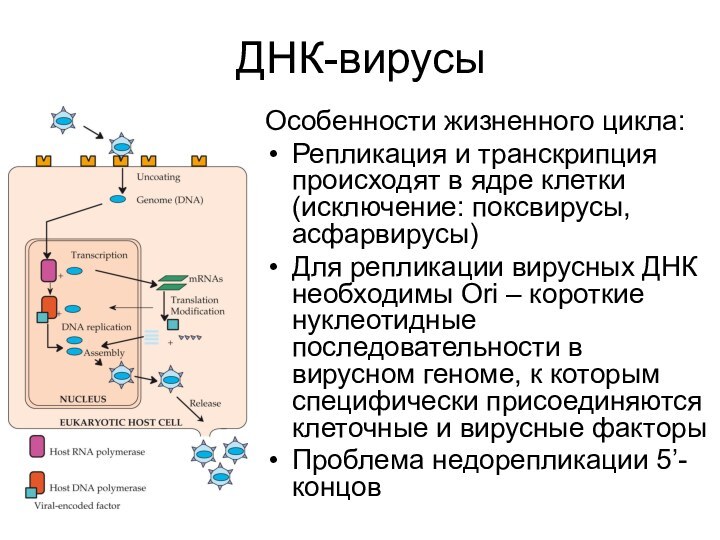
Презентация на тему ДНК-вирусы
Содержание
- 2. Стратегии репликации ДНК-вирусов
- 3. Стратегии репликации ДНК-вирусов
- 4. РНК-вирусы
- 5. РНК-вирусы
- 6. «Тактические приёмы», используемые вирусами при экспрессии геномовТранскрипционный уровеньСинтез субгеномных РНК«Кража» кэп-структурыПосттранскрипционный уровеньАльтернативный сплайсингРедактирование мРНК
- 7. «Тактические приёмы», используемые вирусами при экспрессии геномовТрансляционный
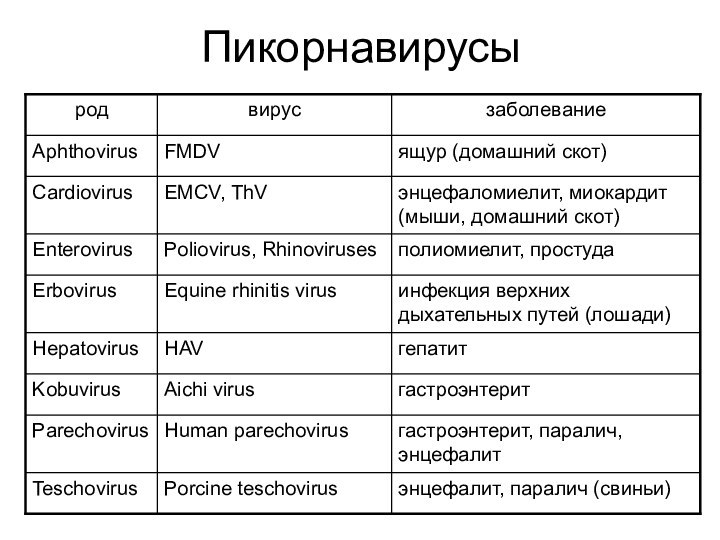
- 8. Пикорнавирусы
- 9. Клеточные рецепторы, используемые пикорнавирусами
- 10. Рибосомальный пропуск«2A-like»/CHYSEL-последовательность (cis-acting hydrolase element): Asp-Val/Ile-Glu-X-Asn-Pro-Gly↓Pro
- 11. Cre (cis-acting replication element)сre – шпилька в
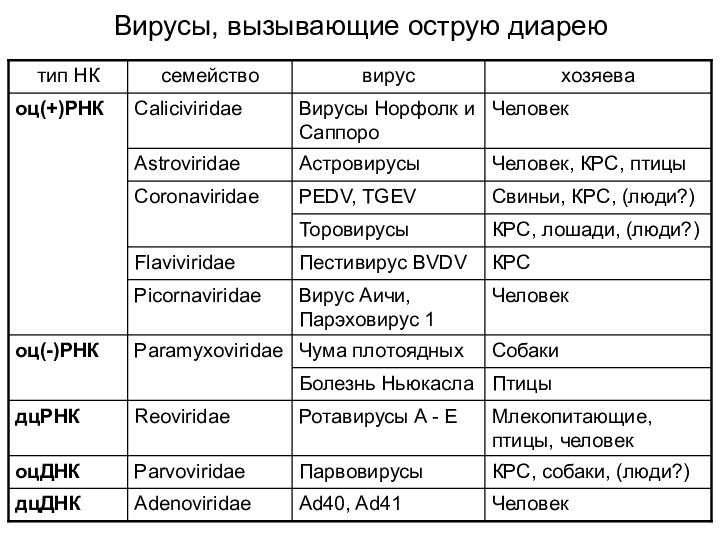
- 12. Вирусы, вызывающие острую диарею
- 13. Тогавирусы
- 14. Функции неструктурных белков альфавирусовnsP1 – кэпирующий ферментnsP2
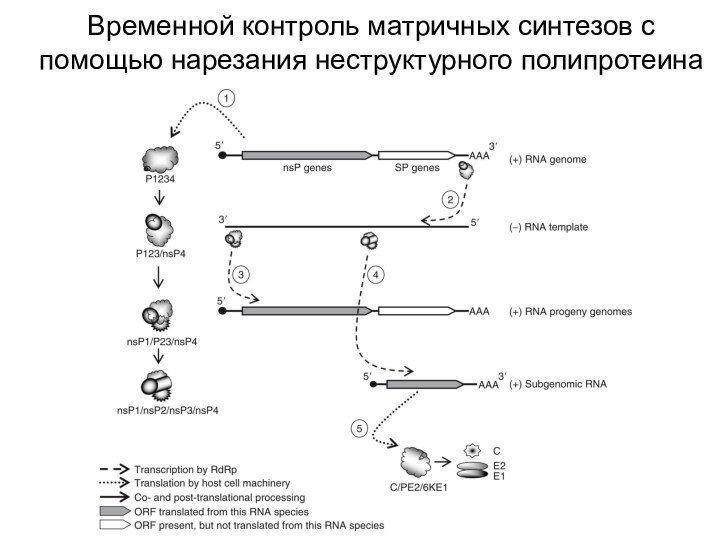
- 15. Временной контроль матричных синтезов с помощью нарезания неструктурного полипротеина
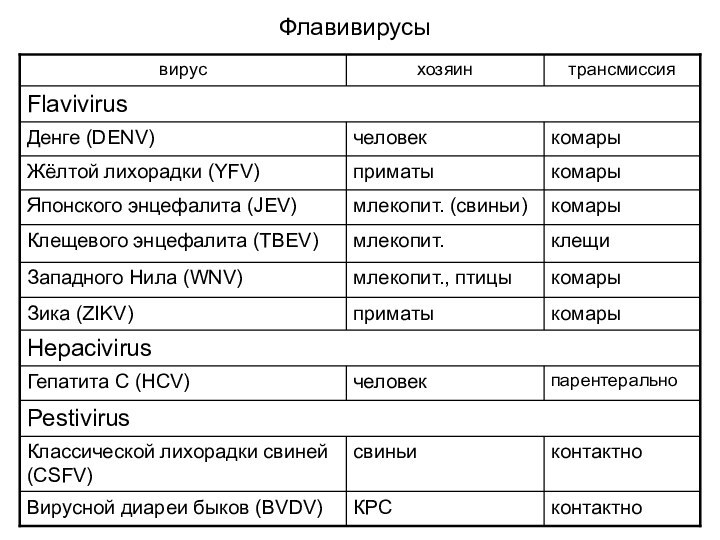
- 16. Флавивирусы
- 17. АрбовирусыБольшинство альфавирусов являются арбовирусами (arthropod-borne) – вирусами,
- 18. Классификация циклов трансмиссииПо количеству хозяев/переносчиковПростой: один вектор
- 19. Особенности арбовирусных инфекцийЗаражение переносчика инфекции возможно в
- 20. Зимовка арбовирусовВ умеренных климатических зонах (в отличие
- 21. порядок: Nidovirales семейство: Coronaviridae род: Coronavirus группа
- 22. (-)РНК-вирусыпорядок: Mononegaviralesсемейство: Rhabdoviridaeсемейство: Filoviridaeсемейство: Paramyxoviridaeсемейство: Bornaviridaeсегментированные (-)РНК-вирусысемейство: Orthomyxoviridaeсемейство: Bunyaviridaeсемейство: Arenaviridae
- 23. Общие свойства (-)РНК-вирусовНаличие внешней липопротеиновой мембраныНуклеокапсид со
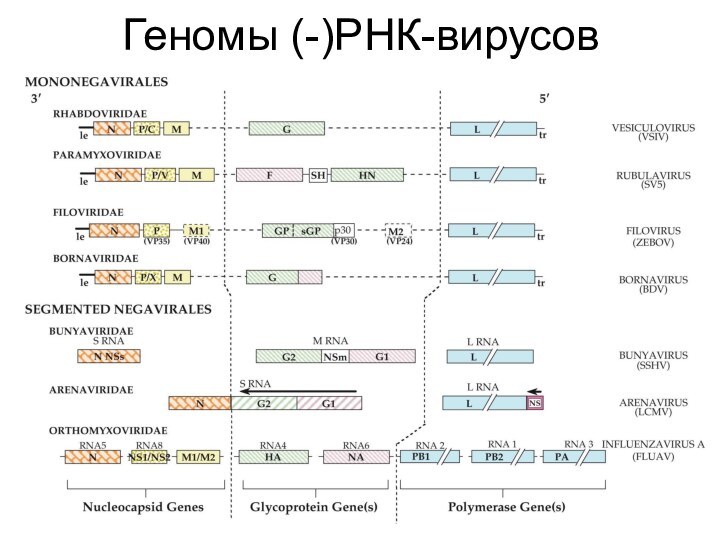
- 24. Геномы (-)РНК-вирусов
- 25. Синтез мРНК (-)РНК-вирусовПосле входа (-)РНК-вируса в клетку
- 26. Репликация генома (-)РНК-вирусовДля репликации (-)РНК необходим синтез
- 27. Ambisense-стратегия
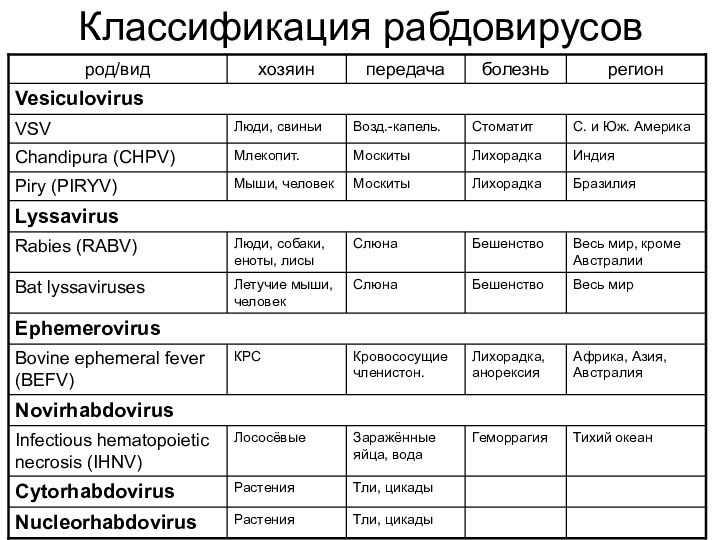
- 28. Классификация рабдовирусов
- 29. Классификация парамиксовирусовпорядок: Mononegaviralesсемейство: Paramyxoviridaeподсемейство: Paramyxovirinae род: Respirovirus (вирусы
- 30. Ген Р и кодируемые им белкиДля синтеза
- 31. Классификация ортомиксовирусов семейство: Orthomyxoviridae
- 32. Строение геномов вирусов гриппа
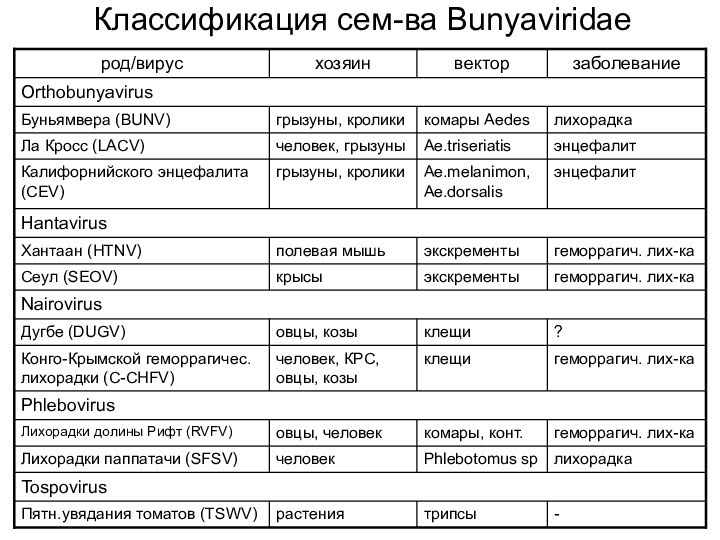
- 33. Классификация сем-ва Bunyaviridae
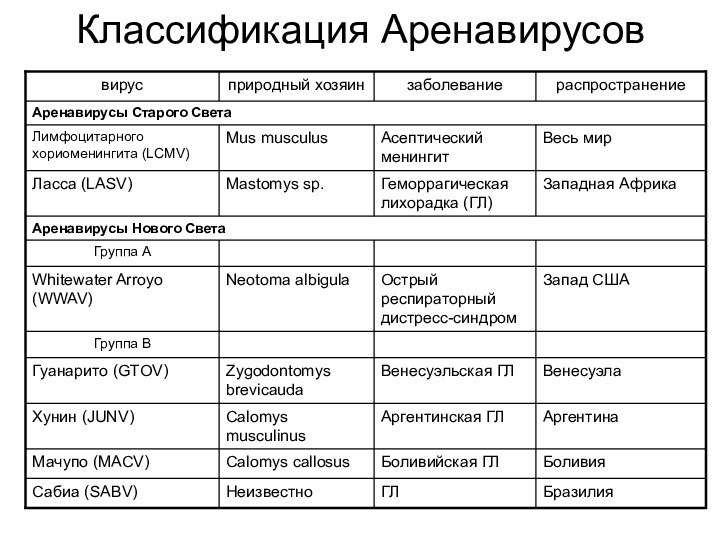
- 34. Классификация Аренавирусов
- 35. Заболевания, вызываемые аренавирусамиЭкология аренавирусов напоминает экологию хантавирусов
- 36. Лимфоцитарный хориоменингитВызывается LCMV – вирусом-прототипом семейства. Естественный
- 37. Лихорадка ЛассаВызывается вирусом Ласса (LASV), естественный резервуар
- 38. Скачать презентацию
- 39. Похожие презентации
Стратегии репликации ДНК-вирусов
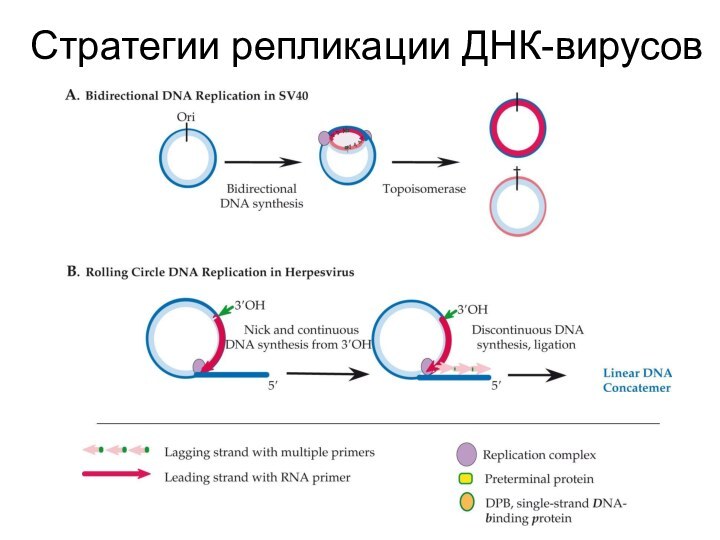
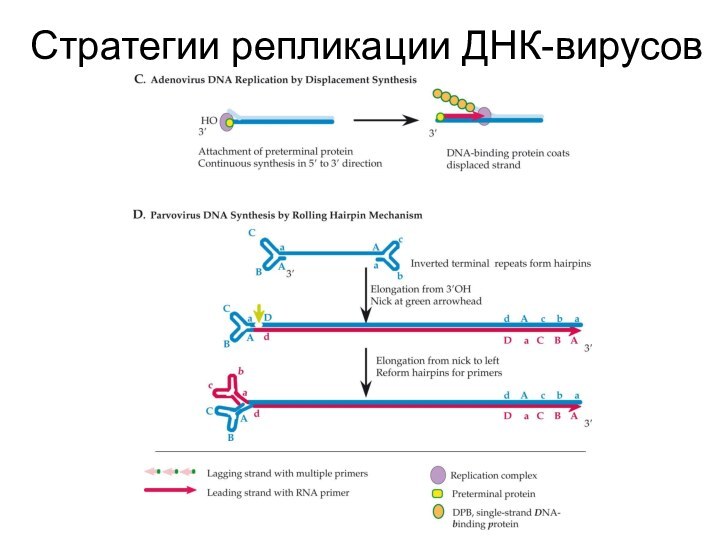
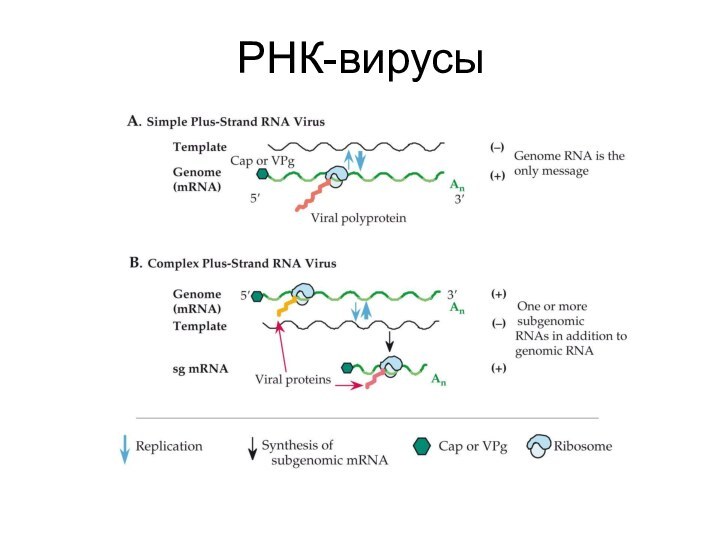
























Слайд 6
«Тактические приёмы», используемые вирусами при экспрессии геномов
Транскрипционный уровень
Синтез
субгеномных РНК
Слайд 7
«Тактические приёмы», используемые вирусами при экспрессии геномов
Трансляционный уровень
Сдвиг
рамки считывания (frameshifting)
Протечка при сканировании (leaky scanning)
Терминация с последующей
реинициациейСупрессия стоп-кодонов
Внутренняя инициация (IRES)
Рибосомальный пропуск (ribosomal skip)
Рибосомальное шунтирование
Посттрансляционный уровень
Разрезание полипротеина
Слайд 10
Рибосомальный пропуск
«2A-like»/CHYSEL-последовательность (cis-acting hydrolase element): Asp-Val/Ile-Glu-X-Asn-Pro-Gly↓Pro
Слайд 11
Cre (cis-acting replication element)
сre – шпилька в 50-100
нуклеотидов с консервативным участком АААСАС
у риновируса 2 сre находится
внутри последовательности 2А, у риновируса 14 - внутри последовательности VP1, а у афтовирусов сre расположен в 5’-НТРсre используется вирусной РНК-полимеразой для уридилирования VPg при синтезе (+)цепи, а поли-А служит матрицей для уридилирования при синтезе (-)цепи
Слайд 14
Функции неструктурных белков альфавирусов
nsP1 – кэпирующий фермент
nsP2 –
хеликаза, папаин-подобная протеаза, РНК-трифосфатаза
nsP3 – ? Функция не известна
nsP4
– РНК-полимеразаНарезание неструктурного полипротеина определяет начало репликации и синтеза сгРНК. Такой механизм помогает не только повысить эффективность синтеза, но и при необходимости снизить вирулентность.
P123/nsP4 синтезирует только (-)РНК
nsP1/P23/nsP4 синтезирует и (+)РНК, и (-)РНК
nsP1/nsP2/nsP3/nsP4 синтезирует только (+)РНК
Слайд 17
Арбовирусы
Большинство альфавирусов являются арбовирусами (arthropod-borne) – вирусами, переносимыми
членистоногими (в основном комарами)
Арбовирусы – несистематическая группа вирусов, включающая
представителей разных вирусных семействЗаболевания человека вызывают арбовирусы семейств:
Togaviridae
Flaviviridae
Bunyaviridae
Слайд 18
Классификация циклов трансмиссии
По количеству хозяев/переносчиков
Простой: один вектор (переносчик)
и один позвоночный хозяин (резервуар)
Сложный: несколько переносчиков и несколько
промежуточных и/или конечных хозяевПо типу распространения заболевания
Энзоотический: заболевание распространено на ограниченной территории и поражает один тип позвоночных хозяев
Эпизоотический: заболевание может поразить нескольких позвоночных хозяев и распространяется на значительной территории
Слайд 19
Особенности арбовирусных инфекций
Заражение переносчика инфекции возможно в достаточно
короткий промежуток времени, когда в позвоночном хозяине наблюдается виремия
(108 инфекционных частиц в 1 мл крови)Арбовирусная инфекция в переносчике проходит как правило бессимптомно, т.к. необходимо, чтобы вектор выжил до следующего кормления кровью
Арбовирусам приходится поддерживать баланс в своей эволюции: изменения генома вируса, ведущие к адаптации к одному хозяину, могут оказаться не подходящими для размножения в другом хозяине
Разные штаммы одного вируса могут использовать разных хозяев (как позвоночных резервуаров, так и беспозвоночных переносчиков) в зависимости от географического положения. Например, вирус Синдбис может заражать птиц, млекопитающих, амфибий и рептилий. Переносчиками могут служить разные виды комаров, а также другие членистоногие, питающиеся кровью (например, клещи)
Слайд 20
Зимовка арбовирусов
В умеренных климатических зонах (в отличие от
тропических) вирус не может поддерживаться в трансмиссионном цикле постоянно.
Поэтому арбовирусы используют различные стратегии для пережидания неблагоприятных климатических условийТрансовариальная трансмиссия: вирус проникает в ооциты в инфицированной самке членистоногого, репликативный цикл вируса прекращается во время диапаузы и развитие эмбриона происходит нормально, при вылуплении переносчик уже оказывается заражённым
Персистентная инфекция в позвоночном хозяине
Реинтродукция в регионы, где трансмиссивный цикл может поддерживаться круглогодично (например, перемещение с мигрирующими птицами)
Слайд 21
порядок: Nidovirales
семейство: Coronaviridae
род: Coronavirus
группа 1
коронавирусы
человека 229, NL63 (HCoV)
вирус трансмиссивного гастроэнтерита свиней (TGEV)
группа 2Акоронавирусы человека OC43, HKU-1 (HCoV)
вирус гепатита мышей (MHV)
группа 2В
вирус атипичной пневмонии (SARS)
группа 3
вирус инфекционного бронхита птиц (IBV)
род: Torovirus
торовирус человека (HuTV)
торовирус лошадей (Berne/EqTV)
торовирус быков (Breda/BoTV)
семейство: Arteriviridae
семейство: Roniviridae
Слайд 22
(-)РНК-вирусы
порядок: Mononegavirales
семейство: Rhabdoviridae
семейство: Filoviridae
семейство: Paramyxoviridae
семейство: Bornaviridae
сегментированные (-)РНК-вирусы
семейство: Orthomyxoviridae
семейство:
Bunyaviridae
семейство: Arenaviridae
Слайд 23
Общие свойства (-)РНК-вирусов
Наличие внешней липопротеиновой мембраны
Нуклеокапсид со спиральной
симметрией
У всех (-)РНК-вирусов - схожий набор генов; у несегментированных
(-)РНК-вирусов – одинаковый порядок расположения генов в геномеВнутри капсида обязательно присутствуют РНК-зависимая РНК-полимераза (L) и кофактор полимеразы (P/NS)
«Голая» (-)РНК неинфекционна
Отсутствуют вирус-специфические протеазы
Слайд 25
Синтез мРНК (-)РНК-вирусов
После входа (-)РНК-вируса в клетку начинается
синтез мРНК с (-)-матрицы с помощью полимеразы, присутствующей в
капсиде.Для несегментированных (-)РНК-вирусов существует единственный сайт посадки полимеразы, которая распознаёт старт- и стоп-сигналы на генах для синтеза дискретных мРНК.
Количество мРНК, синтезированной с каждого конкретного гена, зависит от расположения этого гена в геноме: с 3’-концевых генов синтезируется большее количество мРНК и, следовательно, больше белка.
Большинство мРНК транслируется в единственный белок, но есть и исключения (например, белок Р). При этом используются следующие механизмы: альтернативные старт-кодоны при трансляции, вставки внематричных нуклеотидов при синтезе мРНК или сплайсинг.
Слайд 26
Репликация генома (-)РНК-вирусов
Для репликации (-)РНК необходим синтез комплементарной
копии генома, называемой антигеномной (агРНК) или вирус-комплементарной РНК (вкРНК)
Репликация
(также как и синтез мРНК) всегда осуществляется на матрице, упакованной в капсидный белокГеномы (или геномные сегменты) (-)РНК-вирусов содержат инвертированные повторы на концах, комплементарные друг другу
Слайд 29
Классификация парамиксовирусов
порядок: Mononegavirales
семейство: Paramyxoviridae
подсемейство: Paramyxovirinae
род: Respirovirus (вирусы парагриппа
1 и 3)
род: Rubulavirus (вирусы свинки, парагриппа 2 и
4)род: Morbillivirus (вирус кори)
род: Henipavirus (вирусы Хендра и Нипа)
род: Avulavirus (вирус болезни Ньюкасла)
род: Ferlavirus [2012]
род: Aquaparamyxovirus [2012]
подсемейство: Pneumovirinae
род: Pneumovirus (респираторно-синцитиальный в.)
род: Metapneumovirus (ринотрахеита индюшек в.)
Слайд 30
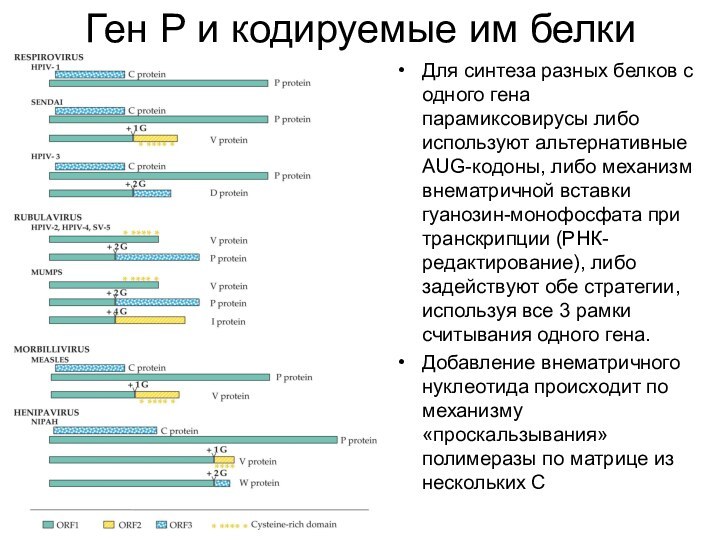
Ген Р и кодируемые им белки
Для синтеза разных
белков с одного гена парамиксовирусы либо используют альтернативные AUG-кодоны,
либо механизм внематричной вставки гуанозин-монофосфата при транскрипции (РНК-редактирование), либо задействуют обе стратегии, используя все 3 рамки считывания одного гена.Добавление внематричного нуклеотида происходит по механизму «проскальзывания» полимеразы по матрице из нескольких С
Слайд 35
Заболевания, вызываемые аренавирусами
Экология аренавирусов напоминает экологию хантавирусов (род
буньявирусов). Вирус устанавливает персистентную инфекцию в грызуне, а человеку
передаётся контактным/воздушно-капельным путями через кал и мочу инфицированных животных. Есть гипотеза, что аренавирусы произошли от хантавирусов, у которых S- и M-сегменты слились в один, что позволило осуществлять более тонкую регуляцию жизненного цикла.Большинство аренавирусов вызывает геморрагические лихорадки.
Клеточный рецептор для проникновения многих аренавирусов – α-дистрогликан (внеклеточный гликопротеид, связывающий ламинин базальной мембраны с β-дистрогликаном клетки). От афинности связывания вируса с α-дистрогликаном зависит вирулентность штамма. Высоковирулентные штаммы вызывают иммуносупрессию.
Слайд 36
Лимфоцитарный хориоменингит
Вызывается LCMV – вирусом-прототипом семейства. Естественный хозяин
– домовая мышь (Mus musculus). LCMV распространён как в
Европе, так и в Америках.Инкубационный период составляет от 1 до 3 недель после инфицирования. У большинства людей повышается температура тела до 38-39 °С и появляется озноб. Другие возможные симптомы - чувство недомогания, тошнота, головокружение, слабость, боли в мышцах, головная боль «позади глаз», усугубляемая ярким светом, и плохой аппетит. Могут возникать боли в горле, болезненность суставов и рвота. Не исключены артриты суставов пальцев. Часто заболевание имеет две стадии: через 1-2 недели после появления гриппоподобных симптомов развивается воспаление оболочки, покрывающей головной мозг (менингит). При этом появляются головная боль и ригидность затылочных мышц. Эти больные обычно выздоравливают полностью. Иногда развивается воспаление головного мозга (энцефалит) с головной болью и сонливостью. Необратимое повреждение нервов нехарактерно, но иногда встречается.
На фоне иммуносупрессии возможны смертельные случаи
Слайд 37
Лихорадка Ласса
Вызывается вирусом Ласса (LASV), естественный резервуар –
мышь Mastomys natalensis.
Распространена в Западной Африке, смертность колеблется от
10 до 15%, но в некоторых вспышках была описана смертность до 60%. Примерная оценка заболеваемости: от 100000 до 300000 случаев в год.При инфицировании человека LASV способен накапливаться в высоких титрах в селезёнке, лёгких, печени, почках, сердце, плаценте и молочных железах.
Инкубационный период варьирует в пределах 6-20 дней. Заболевание чаще начинается постепенно с невысокой лихорадки, сопровождающейся недомоганием, миалгиями, болями в горле при глотании, явлениями конъюнктивита. Через несколько дней при нарастании температуры тела до 39-40°С с ознобом усиливаются слабость, апатия и головная боль, появляются значительные боли в спине, грудной клетке, животе. Возможны тошнота, рвота и диарея. Иногда наблюдают нарушения зрения.
При тяжёлом течении заболевания (35-50% случаев) появляются клинические признаки множественных органных поражений. Развитие геморрагического синдрома свидетельствует о неблагоприятном прогнозе. Развиваются инфекционно-токсический шок, острая почечная недостаточность. В этих случаях в начале 2-й недели заболевания часто наблюдают летальные исходы.
При благоприятном течении заболевания острый лихорадочный период может продолжаться до 3 нед, температура тела снижается литически. Выздоровление протекает очень медленно, возможны рецидивы болезни.