- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Иммуногенетика. Открытие МНС
Содержание
- 2. План 1. Функции МНС2.Характеристика МНС3.Генетическая карта МНС4.Наследование
- 3. Иммуногенетика – раздел иммунологии, изучающий генетические основы становления и развития иммунных реакций
- 4. МНС (Major Histocompatibility Complex) – главный комплекс
- 5. Актуальность
- 6. Первый антиген гистосовместимости — антиген Мас —
- 7. B этом же году впервые было сформулировано
- 8. Открытие МНС. Нобелевская премия 1980 г.Жан
- 9. ФУНКЦИИ МНС
- 10. Биологическая роль МНСРаспознавание «свой – чужой» –
- 11. ХАРАКТЕРИСТИКИ МНС
- 12. Гены комплекса MHC (в отличие от генов
- 13. Характеристики комплекса: ПОЛИМОРФИЗМсуществование большого количества различных специфичностей
- 14. Характеристики комплекса: ПОЛИГЕННОСТЬналичие нескольких неаллельных близкосцепленных генов,
- 15. Характеристики комплекса: ПОЛИГЕННОСТЬ и ПОЛИМОРФИЗМСистема HLA, включает гены1 класса: А, В, С2 класса: DR, DP, DG
- 16. ГЕНЕТИЧЕСКАЯ КАРТА МНС
- 17. Гены MHC делятся на три группы. Каждая
- 18. MHC-I класс Гены групп HLA-A, HLA-B и
- 20. НАСЛЕДОВАНИЕ МНС
- 21. Экспрессия на мембране клеткиГены MHC кодоминантны, т.е.
- 22. СТРОЕНИЕ классических МНС
- 23. Класс IКласс IIЛОКУСЫА, В, СЛОКУСЫDP, DQ, DRКлассификация генов и их продуктов
- 24. МНС I класса
- 25. Молекула I класса состоит из 2-х цепей. Тяжелой α-цепи и легкой β2-микроглобулина
- 26. α-цепь, включает три фрагмента: внеклеточный, трансмембранный и
- 27. Экзонная организация генов, кодирующих α-цепь молекул I
- 28. Экспрессия и функции МНС 1 классаЭкспрессия антигены
- 29. MHC-I «обслуживают» зону цитозоля, сообщающегося через ядерные
- 30. Этапы подготовки вирусных белков к взаимодействию с молекулами I класса главного комплекса гистосовместимости.
- 31. I этап - разрушение вирусных белков, находящихся в цитозоле, с помощью протеазного комплекса - протеосомы.
- 32. II этап - транспорт образовавшихся пептидов во
- 33. III этап - встреча транспортируемых пептидов с
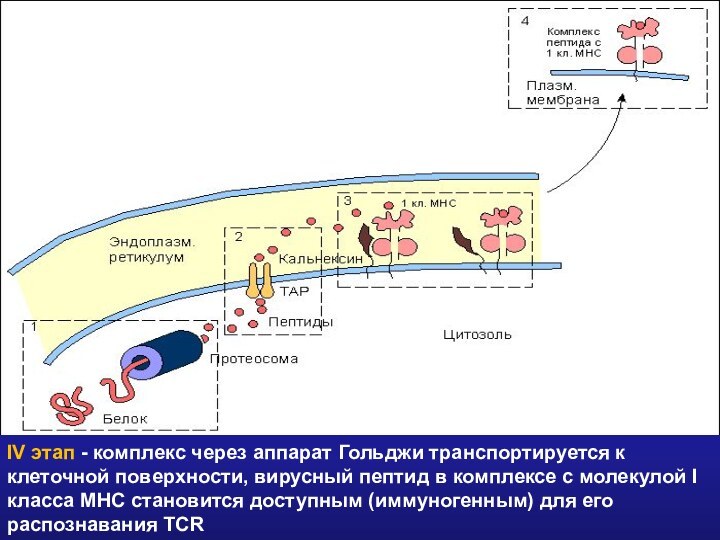
- 34. IV этап - комплекс через аппарат Гольджи
- 36. МНС II класса
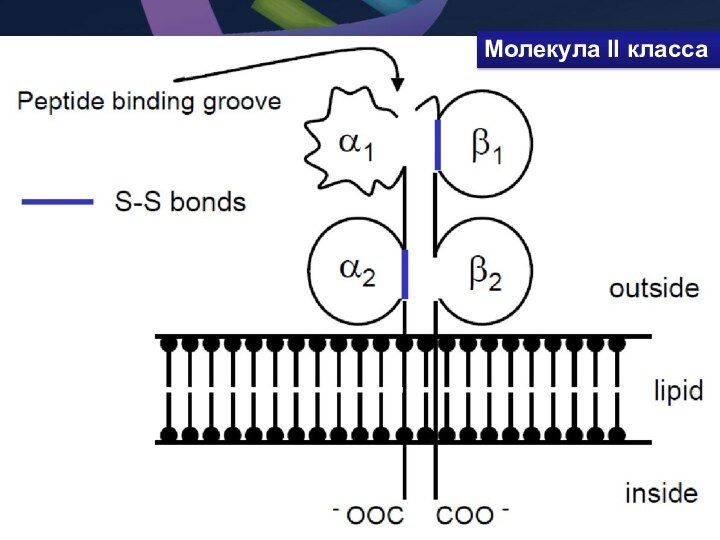
- 37. Молекула II класса
- 38. Молекула II класса гетеродимер из двух нековалентно
- 39. Экзонная организация генов, кодирующих α и β-цепи
- 40. Экспрессия и функции МНС II классаЭкспрессия антигены
- 41. MHC-II. Зона «обслуживания» связана с внеклеточной средой
- 42. Этапы подготовки вирусных белков к взаимодействию с молекулами II класса главного комплекса гистосовместимости.
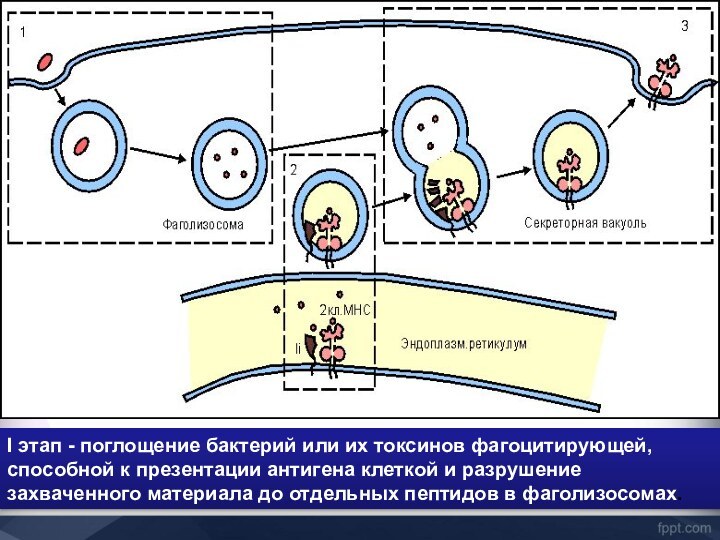
- 43. I этап - поглощение бактерий или их
- 44. II этап - во внутреннем пространстве ЭПР
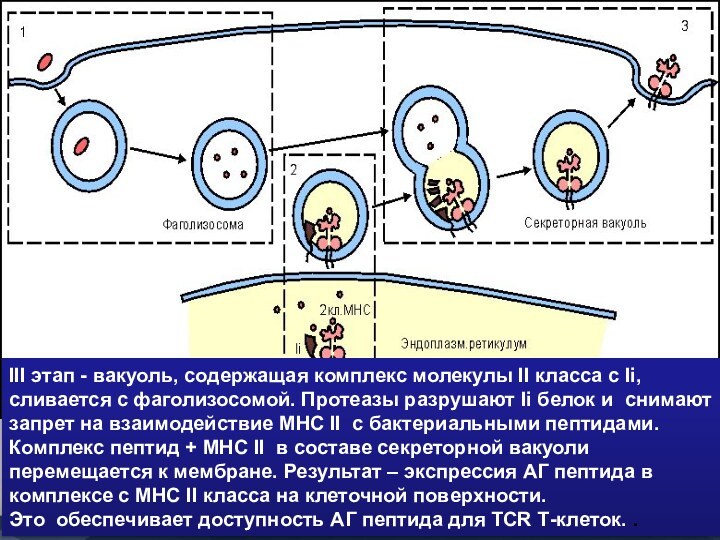
- 45. III этап - вакуоль, содержащая комплекс молекулы
- 49. ЗаключениеИз представленных данных литературы можно сделать вывод
- 50. Скачать презентацию
- 51. Похожие презентации
План 1. Функции МНС2.Характеристика МНС3.Генетическая карта МНС4.Наследование МНС5.Строение классических МНС6.МНС 1 класса7.МНС 2 класса8. Сравнение МНС 1 и МНС 2 класса










































Слайд 2
План
1. Функции МНС
2.Характеристика МНС
3.Генетическая карта МНС
4.Наследование МНС
5.Строение
классических МНС
и МНС 2 классаСлайд 3 Иммуногенетика – раздел иммунологии, изучающий генетические основы становления
и развития иммунных реакций
Слайд 4
МНС (Major Histocompatibility Complex) – главный комплекс гистосовместимости
– система генов, кодирующих антигены, определяющих функционирование иммунной системы
HLA
(Human Leucocyte Antigen) – главный комплекс гистосовместимости человекаH-2 – главный комплекс гистосовместимости мыши
Слайд 6 Первый антиген гистосовместимости — антиген Мас — открыл
в 1958 г. французский исследователь Ж. Доссе. Компьютерный анализ
результатов серологических реакций сывороток много рожавших женщин с донорскими лейкоцитами позволил голландским исследователям описать локус Four (четыре) с генами, контролирующими его продукты — антигены 4а и 4b, впоследствии получившего титул «второго локуса». Двумя годами позже американские исследователи идентифицировали локус LA с аллельной парой антигенов LA1 и LA2, как оказалось впоследствии полностью идентичный антигену Мас. Этот локус впоследствии получил титул «первого». Было доказано, что локусы Four и LA локализуются рядом друг с другом на одной и той же хромосоме, независимо от антигенов 5а и Sb, являются членами одной и той же системы антигенов, которую Ж. Доссе и соавт. назвали системой Hu-I — от «Human-I».Слайд 7 B этом же году впервые было сформулировано предположение
об аллельном полиморфизме генов системы Hu-I. Исследования Ван Руда
и соавторов установили, что локус Four является комплексным (рис. 12.1), помимо генов, кодирующих антигены 4а и 4b, включает ряд генов, кодирующих антигены 6а, 6b, 7а, 7b, 7с и 7d и наследуемых в блоке. Были описаны антигены 8а и 9а. В целом к 1968 г. (рис. 12.1) в системе Нu-I было идентифицировано 15 антигенов. Важнейшую роль в идентификации лейкоцитарных антигенов и в развитии этих исследований сыграли работы Terasaki Р. и McClelland, предложивших для определения антигенов использовать микролимфацитотоксическую реакцию и созданные ими микротехнику и микрооборудование.
Слайд 8
Открытие МНС.
Нобелевская премия 1980 г.
Жан Доссе
Открыл первый
антиген гистосовместимости человека (HLA)
Барух Бенацерраф
Открыл гены иммунного ответа (Ir-гены)
Слайд 10
Биологическая роль МНС
Распознавание «свой – чужой»
– реакция
отторжения трансплантата, РТПХ (реакция трансплантат против хозяина)
Регуляция взаимодействий клеток
иммунной системы – рестрикция вовлечения в иммунный ответ лимфоцитов, через презентацию АГРегуляция силы иммунного ответа на антиген – гены иммунного ответа (Ir) – от англ. immune response
Слайд 12 Гены комплекса MHC (в отличие от генов TCR
и Ig) не подвергаются рекомбинации.
Механизм их приспособления к
вариабельности (неограниченному множеству потенциальных АГ) заключается в их генетическом полиморфизме, полигенности и кодоминантном типе наследованияХарактеристики комплекса
Слайд 13
Характеристики комплекса: ПОЛИМОРФИЗМ
существование большого количества различных специфичностей HLA-генов
в пределах каждого локуса. Гены отличаются между собой по
нуклеотидным последовательностям, входящим в вариабельный участок ДНК
Слайд 14
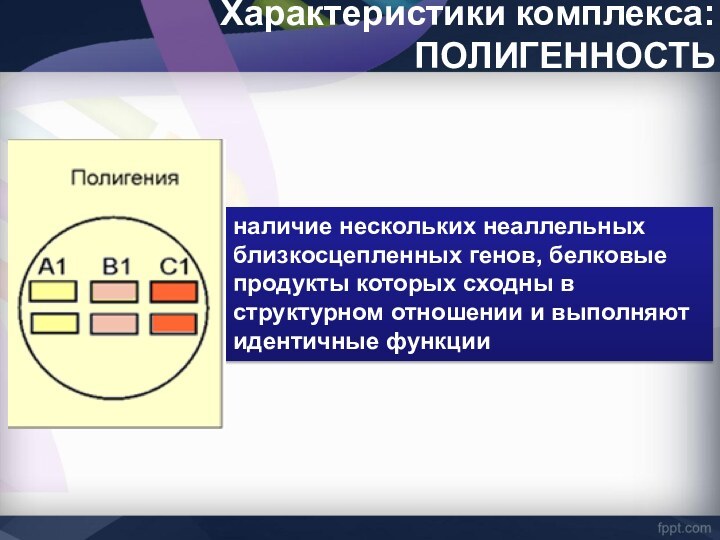
Характеристики комплекса: ПОЛИГЕННОСТЬ
наличие нескольких неаллельных близкосцепленных генов, белковые
продукты которых сходны в структурном отношении и выполняют идентичные
функции
Слайд 15
Характеристики комплекса: ПОЛИГЕННОСТЬ и ПОЛИМОРФИЗМ
Система HLA, включает гены
1
класса: А, В, С
2 класса: DR, DP, DG
Слайд 17
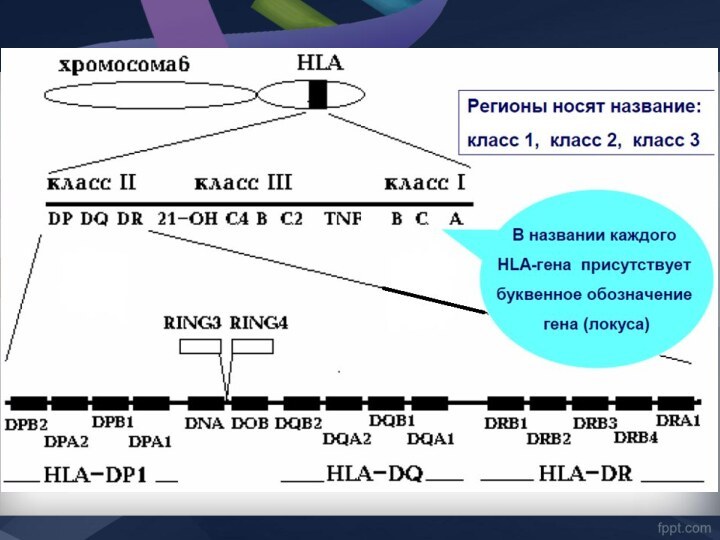
Гены MHC делятся на три группы.
Каждая группа
включает гены, контролирующие синтез полипептидов одного из трех классов
MHC
Слайд 18
MHC-I класс
Гены групп HLA-A, HLA-B и HLA-C
кодируют молекулы MHC класса I.
MHC-II класс
Гены групп HLA-DP,
HLA-DQ и HLA-DR кодируют молекулы MHC класса II.MHC-III обозначает область между MHC-I и MHC-II, здесь картированы гены, кодирующие некоторые компоненты системы комплемента (C4a и C4b, С2, фактора В), цитокинов - (TNF-α и лимфотоксина), 21-гидроксилазы (фермента, участвующего в биосинтезе стероидных гормонов) и др.
Неклассические гены не принадлежат ни к одному из классов MHC. Описано 6 таких генов в области расположения генов MHC-I (Е, F, G, Н, J, X), и 6 - в области MHC-II (DM, DO, CLIP, TAP, LMP, LNA)
Слайд 21
Экспрессия на мембране клетки
Гены MHC кодоминантны, т.е. одновременно
экспрессируются гены материнской и отцовской хромосом. Генов MHC-I по
3 (А, В, С) в каждой из гомологичных хромосом, генов MHC-II - также по 3 (DP, DQ, DR); следовательно, если у матери и отца нет одинаковых аллелей, то каждый человек имеет как минимум 12 различных основных аллелей каждого гена MHC классов I и II, вместе взятых.
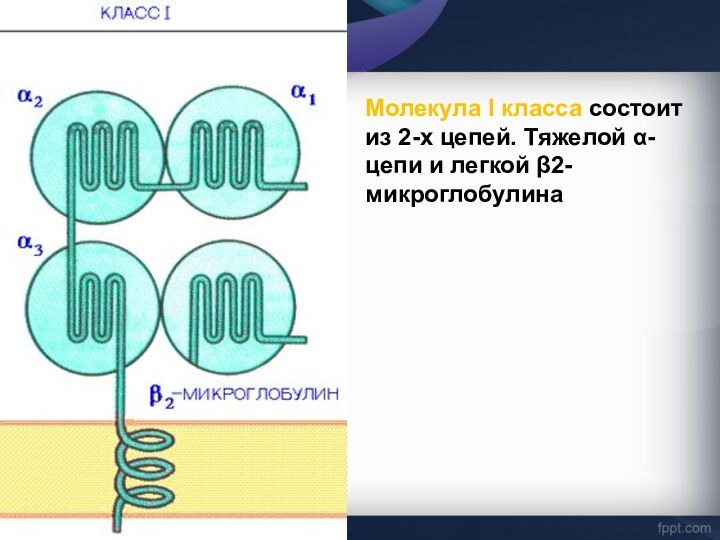
Слайд 26
α-цепь, включает три фрагмента: внеклеточный, трансмембранный и цитоплазматический.
Внеклеточный
содержит 3 домена - α1, α2 и α3. Связывание
антигенного пептида происходит в щели, образованной α1- и α2-доменами.
Слайд 27
Экзонная организация генов, кодирующих α-цепь молекул I класса
1 экзон, кодирующий сигнальный пептид,
4 экзона, кодирующие 3
внешних и трансмембранный домены, 2 экзона, кодирующие небольшой цитоплазматический домен
Слайд 28
Экспрессия и функции МНС 1 класса
Экспрессия
антигены представлены
на всех клетках, тканях и органах, поэтому они являются
главными трансплантационными антигенами.Функции
Реакция отторжения трансплантата;
Рестрикция активности цитотоксических реакций Т-киллеров.
Слайд 29 MHC-I «обслуживают» зону цитозоля, сообщающегося через ядерные поры
с содержимым ядра. Здесь происходит фолдинг синтезированных белковых молекул.
При возникновении ошибок (в том числе и при синтезе вирусных белков) белковые продукты расщепляются в мультипротеазных комплексах (протеосомы). Образующиеся пептиды связываются с молекулами MHC-I, которые представляют T-лимфоцитам внутриклеточно образующиеся пептидные АГ.
Поэтому CD8+ T-лимфоциты, которые распознают комплексы АГ с MHC-I, участвуют в первую очередь в защите от вирусных, а также внутриклеточных бактериальных инфекций
Презентация АГ
Слайд 30
Этапы подготовки вирусных белков к взаимодействию с молекулами
I класса главного комплекса гистосовместимости.
Слайд 31
I этап - разрушение вирусных белков, находящихся в
цитозоле, с помощью протеазного комплекса - протеосомы.
Слайд 32
II этап - транспорт образовавшихся пептидов во внутреннее
пространство эндоплазматического ретикулума с помощью ТАР-1 и ТАР-2, образующих
гетеродимер на эндоплазматической мембране.
Слайд 33
III этап - встреча транспортируемых пептидов с молекулами
I класса МНС. Взаимодействие пептида с молекулой I класса
приводит к отсоединению калнексина. Образовавшийся комплекс пептид: молекула I класса готов к дальнейшему транспорту к плазматической мембране.
Слайд 34
IV этап - комплекс через аппарат Гольджи транспортируется
к клеточной поверхности, вирусный пептид в комплексе с молекулой
I класса МНС становится доступным (иммуногенным) для его распознавания TCRСлайд 38 Молекула II класса гетеродимер из двух нековалентно связанных
цепей α и β, каждая из которых включает два
домена: α1, α2 и β1, β2 (соответственно). Антигенсвязывающую областьобразуют α1- и β1-домены.Слайд 39 Экзонная организация генов, кодирующих α и β-цепи молекул
II класса
1 экзон кодирует лидерную последовательность.
2 и 3
экзоны - первые (α-1 или β-1) и вторые (α-2 или β-2) внешние домены соответственно. 4 экзон кодирует трансмембранный участок и часть цитоплазматического фрагмента .
5 и 6 экзон - цитоплазматический «хвост»
Слайд 40
Экспрессия и функции МНС II класса
Экспрессия
антигены представлены
на макрофагах,
В-лимфоцитах и активированных Т-лимфоцитах.Функции
Реакция трансплантат против хозяина
Рестрикция взаимодействий:
Т-h1
Т-h2
Слайд 41 MHC-II. Зона «обслуживания» связана с внеклеточной средой и
с клеточными органоидами (аппарат Гольджи, ЭПС, лизосомы, эндосомы и
фагосомы).Пептиды, образующиеся в данной зоне, имеют внеклеточное происхождение - это продукты протеолиза белков, захваченных клеткой посредством эндоцитоза или фагоцитоза. Молекулы MHC-II с помощью кальнексина экспонируются внутрь везикул (эндосом или фаголизосом) и только здесь, связавшись с пептидным АГ, принимают необходимую конформацию для дальнейшей экспрессии на мембране клетки.
Таким образом, молекулы MHC-II осуществляют представление АГ при развитии иммунных реакций на внеклеточные инфекции. Главную роль в этих реакциях играют CD4+ T-лимфоциты, распознающие АГ в комплексе с MHC-II.
Презентация АГ
Слайд 42
Этапы подготовки вирусных белков к взаимодействию с молекулами
II класса главного комплекса гистосовместимости.
Слайд 43
I этап - поглощение бактерий или их токсинов
фагоцитирующей, способной к презентации антигена клеткой и разрушение захваченного
материала до отдельных пептидов в фаголизосомах.
Слайд 44
II этап - во внутреннем пространстве ЭПР происходит
сборка молекул II класса, которые до встречи с пептидом
комплексированы со с инвариантной цепью (Ii). Этот белок защищает молекулу II класса от случайной встречи с бактериальными пептидами в эндоплазматическом ретикулуме. Комплекс молекулы II класса с Ii покидает эндоплазматический ретикулум в составе вакуоли.
Слайд 45
III этап - вакуоль, содержащая комплекс молекулы II
класса с Ii, сливается с фаголизосомой. Протеазы разрушают Ii
белок и снимают запрет на взаимодействие МНС II с бактериальными пептидами. Комплекс пептид + МНС II в составе секреторной вакуоли перемещается к мембране. Результат – экспрессия АГ пептида в комплексе с МНС II класса на клеточной поверхности.Это обеспечивает доступность АГ пептида для TCR Т-клеток. .
Слайд 49
Заключение
Из представленных данных литературы можно сделать вывод о
том, что генетически детерминированные различия в силе иммунного ответа
регистрируются в течение всей жизни, а степень реактивности организма определяет начало течения и исход заболевания.Это позволит выявлять «группы риска» при той или иной патологии и проводить профилактику.Наиболее интенсивные исследования в этой области проводятся с 70-х годов, поэтому большинство гипотез и теорий еще не получили достаточного подтверждения. Дальнейшие разработки должны выявить как новые закономерности связей системы HLA, так подтвердить или опровергнуть старые. Новизна затронутой темы и представляет интерес для изучения.