- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фармацевтическая биоэтика и биобезопасность
Содержание
- 2. Фармацевтическая биоэтика – область биоэтики, изучающая моральные,
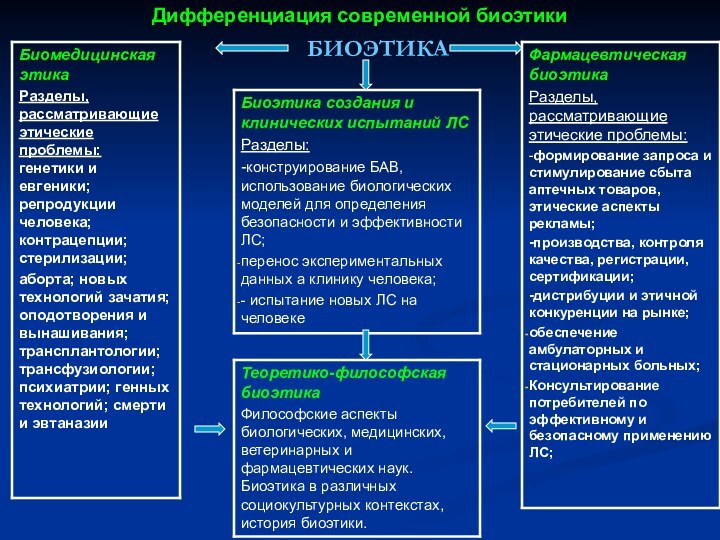
- 3. Дифференциация современной биоэтикиБИОЭТИКА
- 4. Этические проблемы в системе доклинических и клинических
- 5. Требования этичности экспериментаВ принципе использование животных для
- 6. Альтернативные методы экспериментирования- улучшенная система хранения и использования
- 7. «Чем полнее будет проделан опыт на животных,
- 8. КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ Клинические исследования (КИ) – изучение клинических,
- 9. ВИДЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ:открытое, когда все участники испытаний
- 10. КИ проводятся в соответствии с международным стандартом
- 11. Принципы GCP (продолжение)Все привлекаемые к проведению исследования
- 12. ЭТИЧЕСКИЙ КОМИТЕТОсновными задачами этического комитета являются:Проведение качественной
- 13. Для проведения оценки рисков и ожидаемой пользы
- 14. NB!!! ЗАПРЕЩЕНО ПРОВЕДЕНИЕ КИ С УЧАСТИЕМ:Несовершеннолетних, не
- 15. Этические критерии формы рекламирования ЛСФормулировки и иллюстрации
- 16. Реклама ЛС не должна:Обращаться к несовершеннолетним;Содержать ссылки
- 17. Реклама ЛС не должна (продолжение):Представлять объект рекламирования
- 18. Характерные нарушения этических норм в работе мед.
- 19. ВО ВТОРОЙ ПОЛОВИНЕ XX ВЕКА ОБОСТРИЛАСЬ СИТУАЦИЯ
- 20. ЗАДАЧАМИ ФАРМАКОНАДЗОРА являются системные решения, обеспечивающие:создание национальной
- 21. ОБЪЕКТОМ ИЗУЧЕНИЯ ФАРМАКОНАДЗОРА ЯВЛЯЮТСЯ:недостаточная изученность ЛС;недостаточная информированность
- 22. История становления фармаконадзора в Украине Впервые молодому государству
- 23. Международные документы, используемые для гармонизации правового поля
- 24. Нормативная база осуществления фармаконадзора в УкраинеЗакон Украины
- 25. Кем осуществляется фармаконадзор в Украине? п. 1.3. Осуществление
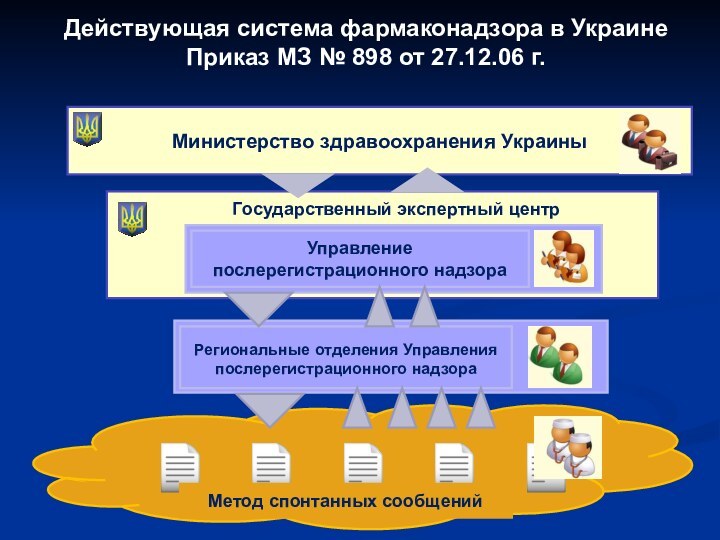
- 26. Действующая система фармаконадзора в Украине Приказ МЗ
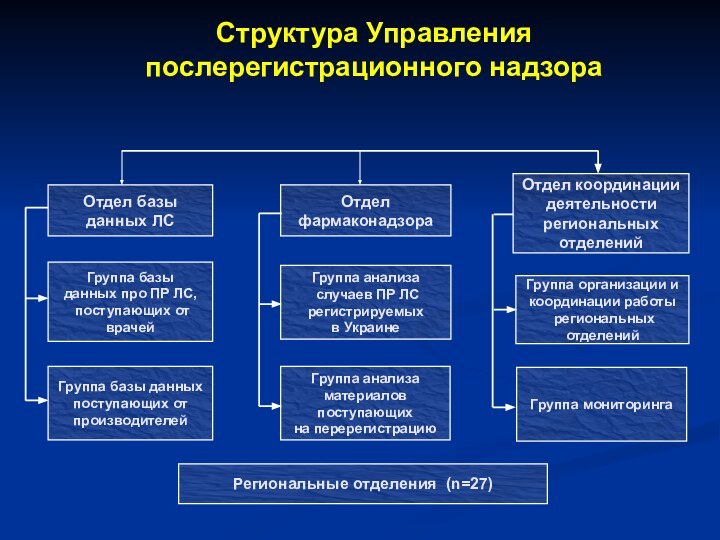
- 27. Структура Управления послерегистрационного надзора
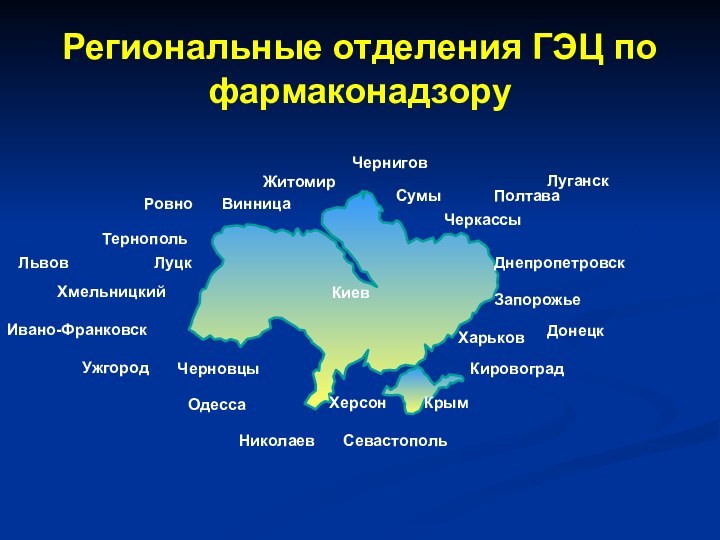
- 28. Региональные отделения ГЭЦ по фармаконадзору
- 29. Основные направления работы системы фармаконадзора в УкраинеИнформационное
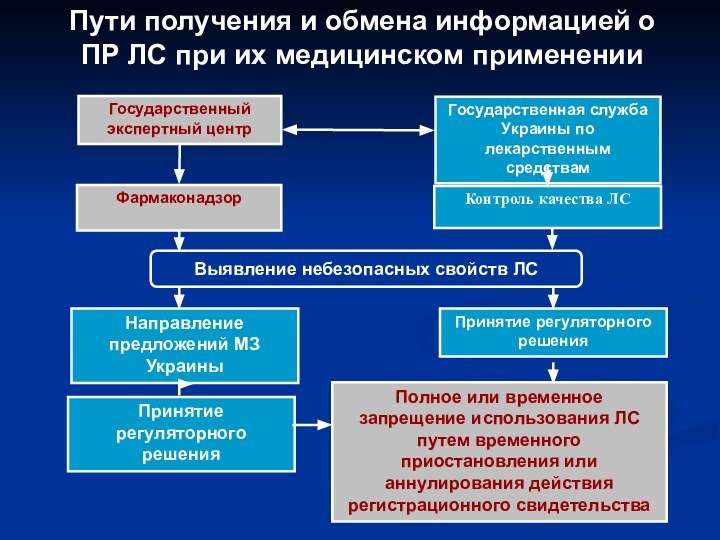
- 30. Пути получения и обмена информацией о ПР ЛС при их медицинском применении
- 31. Основные методы получения информации о безопасности ЛС
- 32. Принципиальная схема получения информации о ПР ЛС методом спонтанных сообщений в Украине от врачей
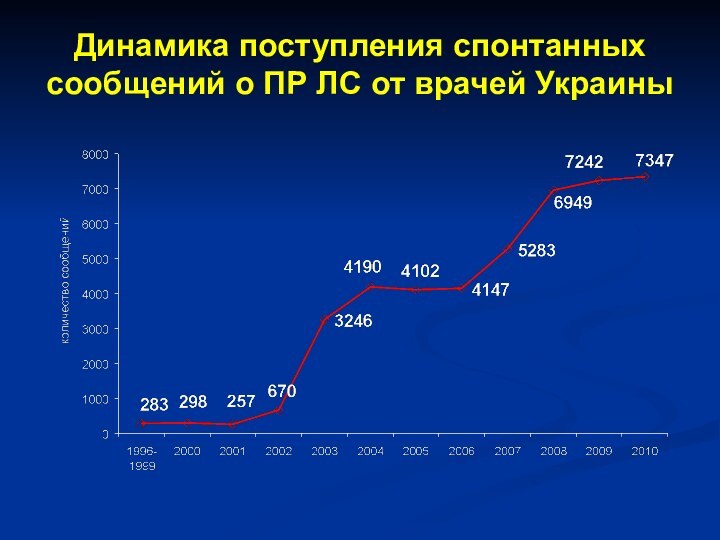
- 33. Динамика поступления спонтанных сообщений о ПР ЛС от врачей Украины
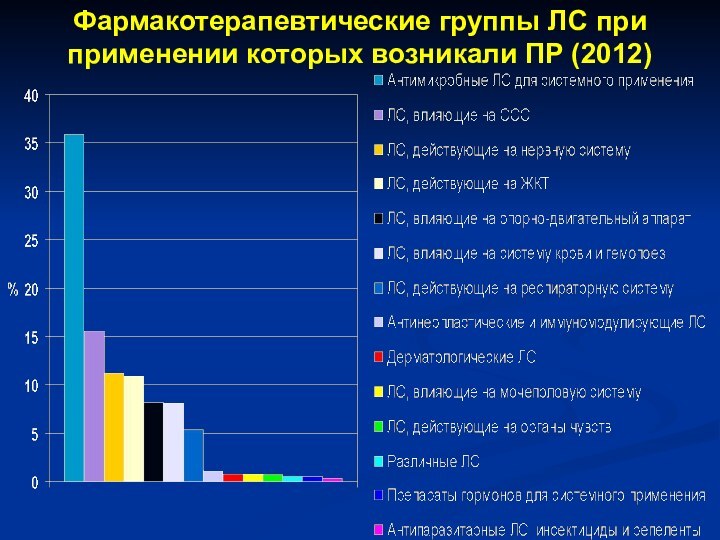
- 34. Фармакотерапевтические группы ЛС при применении которых возникали ПР (2012)
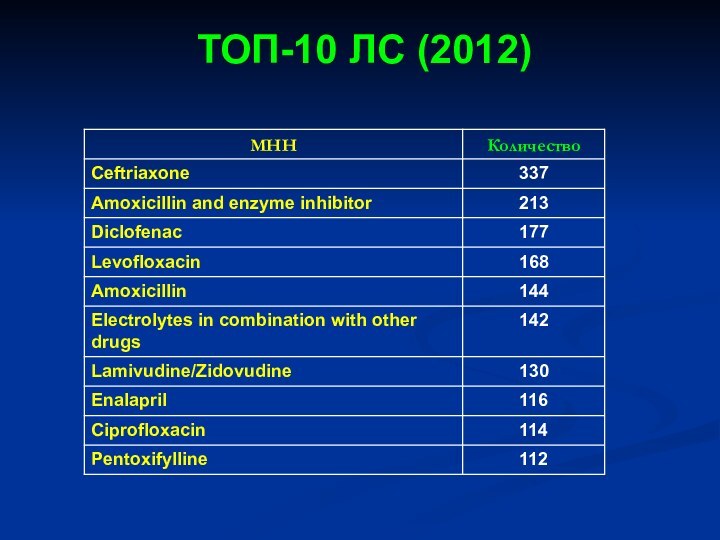
- 35. ТОП-10 ЛС (2012)
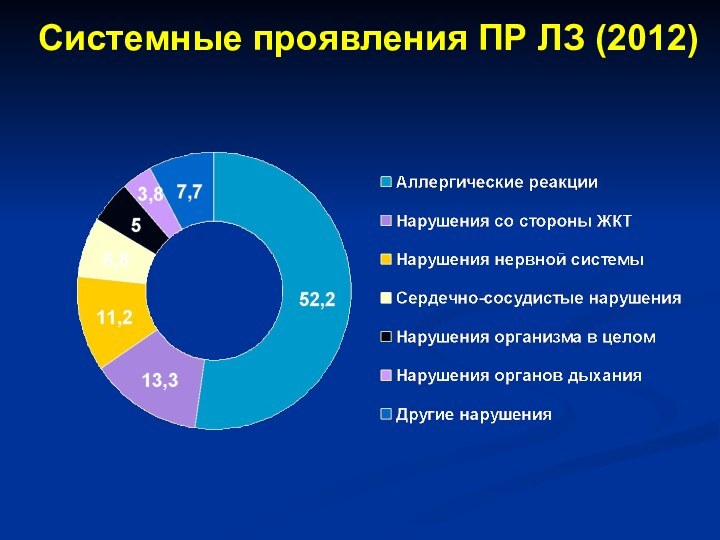
- 36. Системные проявления ПР ЛЗ (2012)
- 37. Распределение ПР ЛС по степени серьезности (2012)79,5%
- 38. Четкое планирование и активизация работы РОВключение в
- 39. По состоянию на сегодня 27% учреждений здравоохранения
- 40. Потенциал национальной базы данных ПР ЛС и
- 41. Используемые критерии оценки безопасности ЛС Частота ПРСоотношение
- 42. Частота ПРСвыше 10% - очень частые, требующие
- 43. В течение 2012 г. в
- 44. Взаимодействие формулярной системы и фармаконадзораМинистерство здравоохранения
- 45. Реальный вклад системы фармаконадзора Украины в процесс
- 46. Скачать презентацию
- 47. Похожие презентации



































Слайд 4 Этические проблемы в системе доклинических и клинических испытаний
ЛС
Цель доклинических исследований ЛС – получение научными методами оценки
и доказательств их эффективности и безопасности.Доклинические исследования включают в себя химические. Физические, биологические. Микробиологические, фармакологические, токсикологические и другие экспериментальные исследования.
Доклинические исследования в Украине проводятся согласно международным правилам лабораторной практики – Good Laboratory Practice – GLP – это процедуры и требования в отношении оценок ЛС и использования экспериментальных животных при этом.
Доклинические исследования ЛС проводятся в соответствии с международными правилами, с максимальной гуманностью умерщвления и проведения самих экспериментов.
Слайд 5
Требования этичности эксперимента
В принципе использование животных для научных
целей нежелательно;
- по возможности следует применять методы, не требующие
использования животных;При существующем уровне знаний использование животных является неизбежным;
Моральный долг ученого – гуманно относиться к подопытным животным, по возможности не причинять им боли и неудобств и постоянно стремиться изыскивать способы поучения того же результата без привлечения живых животных;
- животным, предназначенным для медико-биологических исследований, следует обеспечивать наилучшие из возможных условия их содержания.
В последнее время для решения этических проблем руководствуются концепцией «трех R» Рассела и Берча: замена (replacement), уменьшение (reduction), повышение качества (refinement).
Слайд 6
Альтернативные методы экспериментирования
- улучшенная система хранения и использования информации,
а также обмен информацией об экспериментах, уже проведенными над
животными, во избежание повторения таких процедур;использование физических и химических приемов, а также прогнозов, основанных на физических и химических свойствах молекул;
- использование математических и компьютерных моделей, в том числе моделирование количественных отношений типа «структура – действие»; моделирование биохимических и физиологических процессов;
использование in vitro-методов, в том числе подклеточных фракций, кратковременного хранения слоев ткани, суспензии клеток, а также клеточное и органотипичное выращивание;
использование низших организмов с ограниченной чувствительностью;
использование позвоночных животных на ранних этапах их онтогенеза;
эксперименты с участием людей, включая участников-добровольцев, для выявления побочных эффектов, после выведения ЛС на рынок.
Слайд 7 «Чем полнее будет проделан опыт на животных, тем
менее часто больным придется быть в положении опытного объекта
со всеми печальными последствиями» И.П. Павлов
Необходимость проведения ДИ ЛС
- Проведенные исследования на животных в соответствии с современными требованиями являются основой для оценки их безопасного использования в медицинской практике;
Эксперименты на животных необходимы для развития медико-биологических наук, поскольку позволяют лучше понимать законы и механизмы жизненных процессов;
Изучение повреждающего действия исследуемого препарата на организм экспериментальных животных позволяет определить, какие органы и ткани наиболее чувствительны к данному веществу и на что следует обратить особое внимание при клинических испытаниях.
Слайд 8
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Клинические исследования (КИ) – изучение клинических, фармакологических,
фармакодинамических свойств исследуемого препарата у человека, включая процессы всасывания,
распределения, изменения, выведения, с целью получения научными методами оценок и доказательств эффективности и безопасности ЛС, данных об ожидаемых побочных эффектах от применения ЛС и эффектах взаимодействия с другими ЛС.В процессе КИ новых ЛС выделяют 4 взаимосвязанные фазы:
Определение безопасности ЛС и установление диапазона переносимых доз. Исследования проводят с участием здоровых мужчин-добровольцев, в исключительных случаях – больных.
Определение эффективности и переносимости ЛС. Подбирается минимальная эффективная доза, определяются широта терапевтического действия и поддерживающая доза. Исследования проводят на больных той нозологией, для которой предназначен исследуемы препарат (50-300 человек).
Уточнение эффективности и безопасности ЛС, его взаимодействие с другими ЛС в сравнении со стандартными методами лечения. Исследования проводят у большого числа пациентов (тысячи больных).
Пострегистрационные (маркетинговые) исследования изучают токсические действия препарата при длительном приеме, выявляют редкие побочные эффекты.
Слайд 9
ВИДЫ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ:
открытое, когда все участники испытаний знают,
какой препарат получает больной;
- простое слепое – больной не
знает, а исследователь знает, какое лечение было назначено;в двойном слепом – ни штат исследователей, ни больной не знают, получает ли он препарат или плацебо;
тройное слепое – ни штат исследователей, ни проверяющий, ни больной не знают, каким препаратом лечится больной.
Слайд 10 КИ проводятся в соответствии с международным стандартом –
Good Clinical Practice (GCP)
Принципы GCP
КИ должны проводиться в соответствии
с этическими принципами, заложенными Хельсинской декларацией и отраженными в GCP и нормативных требованиях;До начала исследования должна быть проведена оценка соотношения прогнозируемого риска и неудобств с ожидаемой пользой для субъекта исследования ( польза оправдывает риск).
Права, безопасность и благополучие субъекта исследования имеют первостепенное значение и должны превалировать над интересами науки и общества.
Информация (доклиническая и клиническая) об исследуемом продукте должна быть достаточной для обоснования предполагаемого КИ;
КИ должны отвечать научным требованиям и быть четко и подробно описаны в протоколе;
КИ должны проводиться в соответствии с протоколом, утвержденным Этическим советом организации и независимым этическим комитетом;
Ответственность за оказываемую субъектом медицинскую помощь и принятие решений медицинского характера несет врач;
Слайд 11
Принципы GCP (продолжение)
Все привлекаемые к проведению исследования лица
должны иметь соответствующее образование, подготовку и опыт для выполнения
возложенных на них задач;Добровольное информированное согласие должно быть получено у каждого субъекта до его включения в эксперимент;
Всю полученную в КИ информацию необходимо регистрировать, передавать и хранить таким образом, чтобы были обеспечены точность и правильность ее представления, интерпретации и верификации;
Конфиденциальность записей, позволяющих идентифицировать субъектов исследования, должна быть обеспечена с соблюдением права на частную жизнь;
Производство и хранение исследуемых продуктов, а также обращение с ними необходимо осуществлять в соответствии с правилами добротной производственной практики (good manufacturing practice – GMP);
Для обеспечения качества каждого аспекта исследования должны быть внедрены соответствующие системы и операционные процедуры.
Слайд 12
ЭТИЧЕСКИЙ КОМИТЕТ
Основными задачами этического комитета являются:
Проведение качественной этической
экспертизы материалов КИ ЛС с целью защиты испытуемых от
возможных негативных последствий применения ЛС;Уточнение степени этической обоснованности проведения КИ ЛС и предполагаемой эффективности и безопасности изучаемых ЛС;
Подготовка заключений о целесообразности проведения КИ ЛС.
Слайд 13 Для проведения оценки рисков и ожидаемой пользы ЭК
должен убедиться что:
Необходимые данные не могут быть получены без
привлечения к исследованию людей;Исследование рационально спланировано с учетом минимизации дискомфорта и инвазивных процедур для испытуемых;
Исследование служит получению важных результатов, направленных на совершенствование диагностики и лечения данного заболевания;
Исследование базируется на результатах лабораторных данных и экспериментов на животных, а ожидаемые данные лишь подтвердят его обоснованность;
Ожидаемая польза от исследования превышает потенциальный риск, а потенциальный риск, является минимальным;
Исследователь обладает достаточной информацией о предсказуемости любых возможных неблагоприятных последствий исследования;
Испытуемым и их законным представителям предоставлена вся информация, необходимая для получения их осознанного добровольного согласия.
Слайд 14
NB!!! ЗАПРЕЩЕНО ПРОВЕДЕНИЕ КИ С УЧАСТИЕМ:
Несовершеннолетних, не имеющих
родителей;
Беременных женщин, за исключением случаев, если проводятся КИ ЛС,
предназначенных для беременных женщин, и когда полностью исключен риск нанесения вреда беременной женщине и плоду;Лиц отбывающих наказание в местах лишения свободы, а также лиц, находящихся под стражей в следственных изоляторах, без их письменного информированного согласия.
Слайд 15
Этические критерии формы рекламирования ЛС
Формулировки и иллюстрации должны
соответствовать научным данным о медико-биологических свойствах конкретного препарата;
Рекламный материал
служит лишь напоминанием, его содержание может быть сокращено, но он обязательно должен содержать информацию о фирме-производителе, оптовой фирмой с целью получения дополнительных сведений;Реклама для широких слоев населения должна помогать людям принимать разумные решения по использованию ЛС, отпускаемых без рецепта;
Реклама не должна злоупотреблять заботой людей о своем здоровье;
Язык рекламного материала должен быть понятен гражданам, но обязательно соответствовать одобренным научным данным о медико-биологических свойствах препарата.
Слайд 16
Реклама ЛС не должна:
Обращаться к несовершеннолетним;
Содержать ссылки на
конкретные случаи излечения от заболеваний;
Содержать выражение благодарности физическим лицам
в связи с использованием объекта рекламирования;Создавать представления о преимуществах объекта рекламирования путем ссылки на факт проведения исследований, обязательных для государственной регистрации объекта рекламирования;
Содержать утверждения или предположения о наличии у потребителей рекламы тех или иных заболеваний либо расстройств здоровья;
Способствовать созданию у здорового человека впечатления о необходимости применения объекта рекламирования (кроме ЛС, применяемых для профилактики заболеваний);
Создавать впечатления ненужности обращения к врачу;
Гарантировать положительное действие объекта реламирования, его безопасность, эффективность и отсутствие побочных действий;
Слайд 17
Реклама ЛС не должна (продолжение):
Представлять объект рекламирования в
качестве БАД и пищевой добавки или иного не являющегося
ЛС товара;Содержать утверждения о том, что безопасность и/или эффективность объекта рекламирования гарантированы его естественным происхождением;
Использовать образы медицинских и фармацевтических работников, за исключением такого использования в рекламе медицинских услуг, средств личной гигиены;
Касаться показаний по таким заболеваниям как туберкулез, заболевания, передаваемые половым путем, иные серьезные инфекционные заболевания, онкологические заболевания, психические заболевания и хроническая бессонница, сахарный диабет и иные болезни обмена веществ, «острый живот».
Слайд 18
Характерные нарушения этических норм в работе мед. представителей:
Предложение
врачам готовых рецептурных бланков – 99%
Предоставление бесплатных образцов без
просьбы врача – 73%Предложение поощерения за продвижение рекламируемого препарата – 90%
Проведение медицинскими представителями некорректных сравнений рекламируемых препаратов с аналогами – 90%
Некорректное поведение медицинских представителей – 10%
Слайд 19 ВО ВТОРОЙ ПОЛОВИНЕ XX ВЕКА ОБОСТРИЛАСЬ СИТУАЦИЯ В
ОБЛАСТИ БЕЗОПАСНОСТИ ПРИМЕНЕНИЯ ЛС.
Постоянно увеличивается число сообщений о нежелательных
побочных реакциях. В глобальной базе данных ВОЗ по данной проблеме содержатся миллионы сообщений.Реакцией на создавшуюся ситуацию стало формирование нового медиуо-фармацевтическогот направления в науке «фармацевтическая бдительность» (фармаконадзор, Pharmocovigilance).
Цель этого направления – обеспечение безопасности больных при применении ЛС. В том числе снижение заболеваемости и смертности вследствии их использования.
Слайд 20
ЗАДАЧАМИ ФАРМАКОНАДЗОРА являются системные решения, обеспечивающие:
создание национальной службы
фармаконадзора;
обучение и подготовку специалистов здравоохранения в области оценки соотношения
польза/риск и рационального использования ЛС;изменение стереотипов в работе врачей с целью сокращения ненужного и нерационального назначения ЛС (полипрогмазия);
изменение отношения больных к необоснованному применению лекарств, особенно, самолечение;
реализацию образовательных и информационных программ для медицинских и фармацевтических работников и населения;
выявление и изучение НПР.
Слайд 21
ОБЪЕКТОМ ИЗУЧЕНИЯ ФАРМАКОНАДЗОРА ЯВЛЯЮТСЯ:
недостаточная изученность ЛС;
недостаточная информированность медицинских
и фармацевтических работников и потребителей фармацевтической помощи;
искажение и утаивание
информации о НПР;медицинские ошибки;
применение некачественных и фальсифицированных препаратов;
использование ЛС по неизученным и неразрешенным показаниям;
острые и хронические отравления ЛС;
смертность, вызванная ЛС;
злоупотребления ЛС;
неблагоприятные взаимодействия ЛС с химическими веществами, другими ЛС и пищевыми продуктами.
Слайд 22
История становления фармаконадзора в Украине
Впервые молодому государству в
кратчайший срок жизненно необходимым было создать институции, обеспечивающие формирование
и реализацию государственной политики в области ЛС.
Слайд 23 Международные документы, используемые для гармонизации правового поля системы
фармаконадзора в Украине
Директива 2001/83/ЕС от 06.11.2001 «О своде
законов Сообщества в отношении лекарственных препаратов для человека»Постановление Совета ЕС от 22.07.93 №2309/93 по вопросам фармаконадзора
«Фармаконадзор. Правила ЕС в отношении фармаконадзора за лекарственными препаратами для человека и для применения в ветеринарии» (THE RULES GOVERNING MEDICINAL PRODUCTS IN THE EUROPEAN UNION, VOLUME 9 – Pharmacovigilance Medicinal Products for Human and Veterinary use), разработанного в рамках процесса ICH и принятого в ЕС)
Слайд 24
Нормативная база осуществления фармаконадзора в Украине
Закон Украины «О
лекарственных средствах» 1996 г., с изменениями и дополнениями 1998
г.Приказы МЗ Украины:
27.12.2006 г. № 898 «Об утверждении Порядка осуществления надзора за побочными реакциями ЛС, разрешенных к медицинскому применению в Украине» (гармонизирован с директивами ЕС)
24.07.2009 г. № 531 «Об утверждении Порядка осуществления мониторинга безопасности и эффективности ЛС в стационарах учреждений здравоохранения”
01.09.2009 г. №654 «Об утверждении Плана мероприятий по улучшению осуществления послерегистрационного надзора за безопасностью и эффективностью ЛС в стационарах учреждений здравоохранения»
31.08.2010 г. № 736 “О мероприятиях по внедрению мониторинга безопасности и эффективности ЛС в стационарах учреждений здравоохранения”
Слайд 25
Кем осуществляется фармаконадзор в Украине?
п. 1.3. Осуществление надзора
за побочными реакциями лекарственных средств, разрешенных к медицинскому применению, возложено
МЗ Украины на ГП «Государственный экспертный центр МЗ Украины».(Приказ МЗ Украины
от 27.12.2006г. №898 п.1.3)
Слайд 26 Действующая система фармаконадзора в Украине Приказ МЗ №
898 от 27.12.06 г.
Министерство здравоохранения Украины
Государственный экспертный центр
Управление послерегистрационного
надзора
Региональные отделения Управления послерегистрационного надзора
? ? ? ? ?
Метод спонтанных сообщений
Слайд 29
Основные направления работы системы фармаконадзора в Украине
Информационное и
методическое обеспечение системы здравоохранения по вопросам безопасности ЛС (в
том числе, разработка и проведение специализированных и общих тренинговых программ, курсов. За последние 2 года в тренингах приняло участие 28 459 чел.)Осуществление сбора, анализа и обобщения информации о безопасности и эффективности применения ЛС, полученной от врачей, производителей, международных организаций.
Осуществление контроля за функционированием ФН в системе здравоохранения и производства ЛС.
Подготовка предложений для МЗ о полном или частичном запрещении медицинского применения ЛС, внесении дополнений или изменений в инструкцию по медицинскому применению ЛС.
Проведение специализированной экспертной оценки перерегистрационных материалов по безопасности ЛС
Слайд 31 Основные методы получения информации о безопасности ЛС в
пострегистрационном периоде
Спонтанные сообщения о подозреваемых ПР ЛС
Фармакоэпидемиологические исследования
Мониторинг ПР ЛС
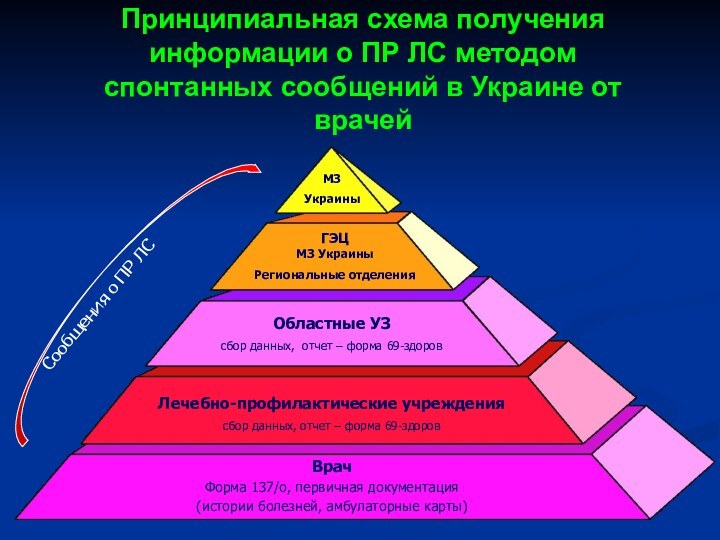
Слайд 32 Принципиальная схема получения информации о ПР ЛС методом
спонтанных сообщений в Украине от врачей
Слайд 37
Распределение ПР ЛС по степени серьезности (2012)
79,5% –
несерьезные ПР
20,5% – серьезные ПР
7,3% случая ПР стали причиной
госпитализаций пациентов5,2% случаев ПР привели к временной нетрудоспособности
4,7% – были угрожающие жизни пациентов
3,9% – привели к продлению госпитализации пациентов
0,1% – закончились летально
Слайд 38
Четкое планирование и активизация работы РО
Включение в состав
РО главных специалистов по специальности “Терапия” МЗ АР Крым,
областных УЗ и городских УЗ г. Киева и СевастополяУтверждение Плана мероприятий по улучшению осуществления надзора за безопасностью и эффективностью ЛС и мониторингу безопасности и эффективности ЛС в стационарах учреждений здравоохранения приказом МЗ Украины от 01.09.2009 р. №654
Усиление регионального, в частности, административного регулирования осуществления фармаконадзора
Слайд 39 По состоянию на сегодня 27% учреждений здравоохранения принимают
участие в осуществлении ФН, путем подачи сообщений О ПР
ЛСВсе учреждения здравоохранения ежегодно подают форму государственной отчетности “69-здоров” о зафиксированных у них случаях ПР ЛС
База данных ГЭЦ МЗ Украины содержит более 46 тыс. сообщений о ПР ЛС
Результаты
Слайд 40 Потенциал национальной базы данных ПР ЛС и ее
программного обеспечения (01.06.2011)
База данных содержит 46
636 сообщений о ПР ЛСПрограммное обеспечение базы данных позволяет оперативно получать следующие данные о:
- ПР фармакологических групп ЛС;
- ПР отдельных ЛС и производителей;
- предвиденности ПР;
- серьезности ПР;
- системных, симптомных проявлениях ПР;
- ПР в демографических группах;
- ПР, зависящих от гендерных особенностей;
- ПР при различных заболеваниях;
- последствиях ПР
- категории ПР
- причинно-следственной связи
- средствах коррекции ПР
Слайд 41
Используемые критерии оценки безопасности ЛС
Частота ПР
Соотношение количества
непредвиденных к предвиденным ПР, серьезных к несерьезным ПР
Распространенность ПР
среди случаев заболеваний Формирование и подтверждение сигнала
Соотношение польза/риск
Слайд 42
Частота ПР
Свыше 10% - очень частые, требующие обязательного
проведения профиля безопасности ЛС или немедленного принятие соответствующих регуляторных
решений1-10% - частые, требующие или проведения изучения профиля безопасности ЛС, или предоставления планов управления рисками, или внесения ограничений/предостережений в инструкцию для медицинского применения
0,1-1% - нечастые
0,01-0,1% - редкие
менее 0,01% - редчайшие
Слайд 43 В течение 2012 г. в инструкции
по медицинскому применению более чем 200 ЛС были внесены
изменения и дополнения по результатам экспертизы перерегистрационных материалов в соответствии с существующей современной информацией по безопасности ЛС
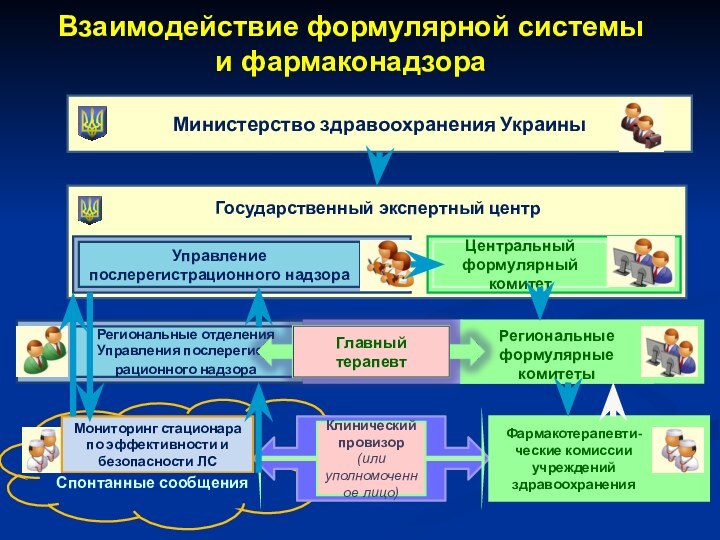
Слайд 44
Взаимодействие формулярной системы
и фармаконадзора
Министерство здравоохранения Украины
Государственный экспертный
центр
Управление послерегистрационного надзора
Региональные отделения Управления послерегист-рационного надзора
Центральный формулярный
комитетРегиональные формулярные комитеты
Мониторинг стационара по эффективности и безопасности ЛС
Спонтанные сообщения
Клинический
провизор (или уполномоченное лицо)
Фармакотерапевти-ческие комиссии учреждений здравоохранения
Слайд 45 Реальный вклад системы фармаконадзора Украины в процесс безопасного
применения ЛС (2009-2012)
Путем формирования сигнала были внесены изменения в
информацию по безопасности препаратов, действующим веществом которых является:кверцетин
L-лизина эсцинат
натрия хлорид
декстран (раствор глюкозы, реополиглюкин)
раствор Рингера, Рингера лактата
тивортин
афлубин
В 2010 г. внесены изменения и дополнения в инструкции для медицинского применения ряда инфузионных растворов и кровезаменитей в соответствии с современными данными по безопасности ЛС и экспертизы перерегистрационных материалов (созданы типовые инструкции)