Слайд 2
Лучевая болезнь человека – комплекс проявления поражающего действия
ионизирующих излучений на организм.
Особенности проявлений ЛБ зависит от
ряда факторов:
вида облучения и пространственного фактора (общее, местное, внешнее, от инкорпорированных источников, равномерное, неравномерное);
временного фактора (однократное, многократное, хроническое);
Источники данных о ЛБ человека: испытания атомного оружия (Хиросима, Нагасаки); радиационные аварии, облучение при терапии лейкозов и др.
Слайд 3
Острая лучевая болезнь человека (ОЛБ)
Возникает (в основном)
в результате однократного тотального внешнего относительно равномерного облучения
ОЛБ возникает
у человека при облучении в сроки от секунд до 3 суток в дозах, превышающих 1 Гр (ЛД50= 2,5-4 для γ-излучения)
При меньших дозах отмечают реакции со стороны отдельных систем различной степени выраженности или клинические проявления вообще отсутствуют.
Слайд 4
Степени тяжести ОЛБ
При дозе 1-2 Гр –
ОЛБ I (легкой) степени;
При дозе 2-4 Гр – ОЛБ
II (средней) степени;
При дозе 4-6 Гр – ОЛБ III (тяжелой) степени;
При дозах выше 6 Гр – ОЛБ IV (крайне тяжелой) степени, при этом выделяют формы ОЛБ:
Доза 6-10 Гр (переходная форма) – тяжелый костномозговой синдром и поражение кишечника (выживание возможно в редких случаях при адекватном лечении),
Доза 10-20 Гр (кишечная форма) – желудочно-кишечный синдром, гибель через 8-16 суток;
Доза 20-80 Гр (токсемическая форма) – сосудистые расстройства и нарушения метаболизма (капилляртоксикоз) – гибель на 4-7 сутки:
Доза выше 80 Гр (церебральная форма) – судороги и неврологические расстройства – гибель в первые часы или до 3-х суток.
Слайд 5
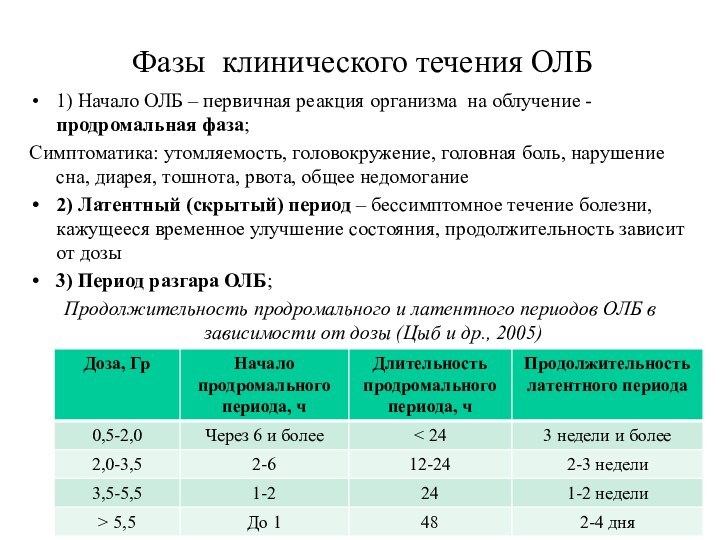
Фазы клинического течения ОЛБ
1) Начало ОЛБ – первичная
реакция организма на облучение - продромальная фаза;
Симптоматика: утомляемость, головокружение,
головная боль, нарушение сна, диарея, тошнота, рвота, общее недомогание
2) Латентный (скрытый) период – бессимптомное течение болезни, кажущееся временное улучшение состояния, продолжительность зависит от дозы
3) Период разгара ОЛБ;
Продолжительность продромального и латентного периодов ОЛБ в зависимости от дозы (Цыб и др., 2005)
Слайд 6
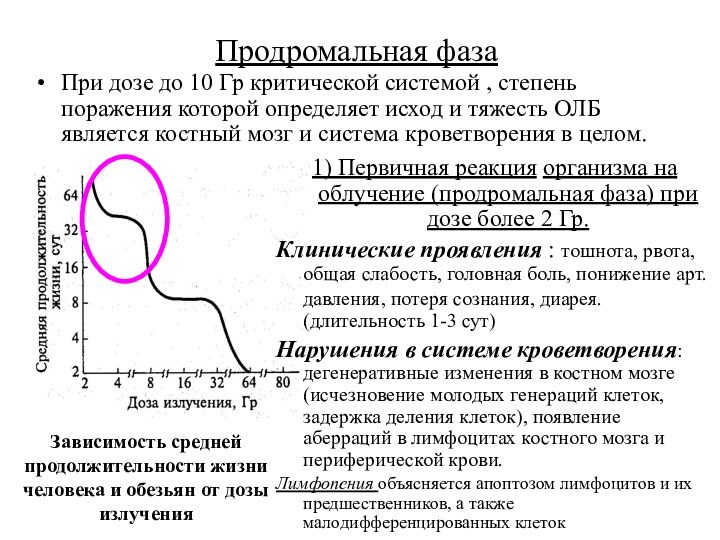
Продромальная фаза
При дозе до 10 Гр критической системой
, степень поражения которой определяет исход и тяжесть ОЛБ
является костный мозг и система кроветворения в целом.
Зависимость средней продолжительности жизни человека и обезьян от дозы излучения
1) Первичная реакция организма на облучение (продромальная фаза) при дозе более 2 Гр.
Клинические проявления : тошнота, рвота, общая слабость, головная боль, понижение арт.давления, потеря сознания, диарея. (длительность 1-3 сут)
Нарушения в системе кроветворения: дегенеративные изменения в костном мозге (исчезновение молодых генераций клеток, задержка деления клеток), появление аберраций в лимфоцитах костного мозга и периферической крови.
Лимфопения объясняется апоптозом лимфоцитов и их предшественников, а также малодифференцированных клеток
Слайд 7
Фазы развития ОЛБ (Ярмоненко, Вайнсон, 2003)
Скрытая стадия
ОЛБ – латентный период (отсутствие клинических признаков болезни), может
длиться до 30 суток, возможные проявления: выпадение волос, подавление сперматогенеза
нарушения в системе кроветворения: снижение числа тромбоцитов, лейкоцитов (лимфоцитов, нейтрофитов и ретикулоцитов)
Фаза выраженных клинических проявлений, наступает спустя 1-4 недель, длится 1-3 недели.
Клинические проявления: инфекционные осложнения, кровоточивость, анемия, нарушение обмена веществ, понос, потеря аппетита, снижение массы тела.
нарушения в системе кроветворения: в периферической крови находятся из лейкоцитов в основном лимфоциты, в костном мозге наблюдаются признаки регенерации.
Фаза восстановления (продолжительность 2-2,5 мес) – исчезновение клинических симптомов,
(нормализация морфологического состава крови, рост волос возобновляется ч/з 4 мес, сперматогенез – через 4-6 мес.)
Слайд 8
Особенности ОЛБ человека
(несмотря на сходства проявлений радиационного
поражения у всех животных)
Доза 2-3 Гр - достаточна
для развития костно-мозгового синдрома у человека; у крыс, мышей и кроликов для этого необходимо 6-8 Гр;
Различаются времена проявления типичных симптомов у человека и животных (у человека костно-мозговой синдром развивается на 4-5 неделю, у крыс, кроликов, собак, свиней, обезьян и др. – на 2-3 неделю после облучения).
Клинические симптомы у человека и животных не совпадают:
Размеры тела человека приводят к неоднородности облучения (доза для разных сегментов тела отличается в несколько раз)
Ни у одного из животных не удается вызвать радиационный синдром, в точности совпадающий с наблюдающимся у человека.
Слайд 9
Пример: межвидовая радиочувствительность мужских половых клеток (по Цыб
и др., 2005)
Макака-резус < золотистый хомячок < китайский хомячок
< морская свинка < кролик < мышь < человек < крыса
Александр Марков "Эволюция человека" 2 т., 2011
Слайд 10
Случаи неравномерного облучения человека (общего неравномерного или локального)
встречаются гораздо чаще, чем случаи общего равномерного облучения
При изучении
поражений от неравномерного облучения применяют концепцию критического органа (ответственного за исход заболевания при данной дозе и форме лучевого поражения)
Примеры:
при внешнем воздействии слабопроникающего бета-излучения или рентгеновского излучения низкой энергии критическим органом становится кожа (воздействие газовой фазы выбросов при аварии на ЧАЭС) – осложнения: почечно-печеночная недостаточность, интоксикация, энцефалопатия
при локальном облучении в очень больших дозах (30-50 Гр) критическими органами оказываются петли кишечника, сердце, легкое и пр. смерть наступает от перитонита, сепсиса и пр. – раньше, чем проявляется поражение органов кроветворения.
ОЛБ человека при неравномерном облучении
Слайд 11
Патомеханизмы, проявляющиеся в результате ожога и лучевого поражения
(Цыб, с.231)
Слайд 12
Современные методы терапии ОЛБ
1.Заместительная терапия
Замещение костного мозга 1930-е

гг - первые эксперименты (неудачные)
Для выживания 10-100% мышей (в
зависимости от дозы облучения) достаточно сохранить жизнеспособность (заэкранировать или ввести извне) 0,05-0,1 % собственных стволовых клеток (200-400).
(хранить или перепрограммировать? нобелевская премия по физиологии и медицине 2012 г – индуцированные стволовые клетки)
Эффективной может быть пересадка как:
аутологичного (собственного),
изологичного (от организмов одной линии* или однояйцевых близнецов),
гомологичного (от животных того же вида, но генетически неоднородных),
гетерологичного (от животных другого вида) костного мозга.
Доказано, что организм летально облученного реципиента регенерирует костный мозг донора (показано с помощью хромосомных маркеров)
Радиационные химеры – животные, образованные при изологичных пересадках (крысы, морские свинки, мыши)
линейные животные, полученные в результате скрещивания близкородственных особей на протяжении не менее 20 поколений.
Слайд 13
Нобелевская премия по физиологии и медицине 2012 г.
Нобелевскую

премию по физиологии и медицине в 2012 году получили Джон Гардон (John
B. Gurdon) и Шинья Яманака (Shinya Yamanaka) «за открытие факта, что зрелые клетки могут быть „перепрограммированы“ обратно в плюрипотентное состояние». Их открытие продолжает ряд исследований, опровергающих догмы: ранее считалось, что процесс клеточной дифференциации — это «билет в один конец», и клетки, обретшие специализацию, уже никогда не могут вернуться в первичное состояние, когда все пути к дифференциации в различные клеточные линии еще открыты. (Такое состояние называют плюрипотентным.)
В 1962 году британский биолог развития Гардон заложил первый камень в фундамент нового здания, показав, что пересадка ядра эпителиальной клетки взрослой лягушки в икринку, лишенную клеточного ядра, успешно дает начало нормальному головастику, в свою очередь развивающемуся во взрослую лягушку. Это исследование стало предтечей более поздних экспериментов по клонированию животных.
Однако все еще было непонятно, можно ли целую клетку также заставить «де-дифференцироваться», а потом — превратиться в любую из множества других специализированных клеток.
В 2006 году положительный ответ на этот вопрос дал японец Шинья Яманака, использовавший небольшой набор транскрипционных факторов для такого «перепрограммирования». Полученные им клетки получили название индуцированных плюрипотентных стволовых клеток.
Слайд 14
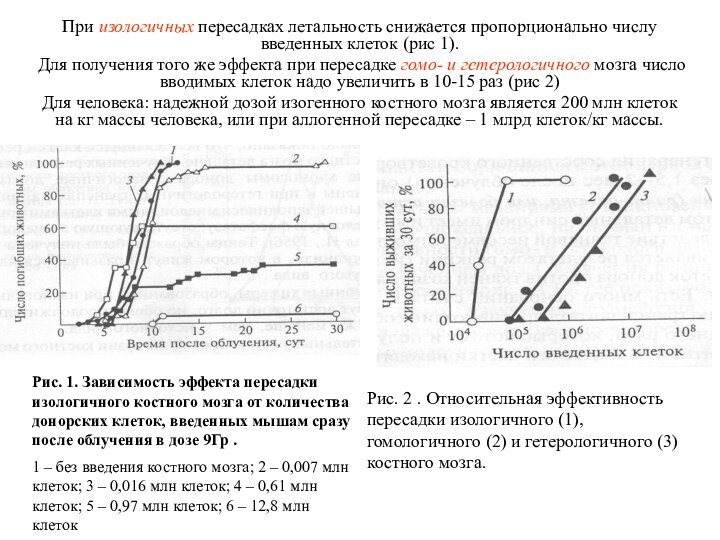
При изологичных пересадках летальность снижается пропорционально числу введенных
клеток (рис 1).
Для получения того же эффекта при пересадке
гомо- и гетерологичного мозга число вводимых клеток надо увеличить в 10-15 раз (рис 2)
Для человека: надежной дозой изогенного костного мозга является 200 млн клеток на кг массы человека, или при аллогенной пересадке – 1 млрд клеток/кг массы.
Рис. 1. Зависимость эффекта пересадки изологичного костного мозга от количества донорских клеток, введенных мышам сразу после облучения в дозе 9Гр .
1 – без введения костного мозга; 2 – 0,007 млн клеток; 3 – 0,016 млн клеток; 4 – 0,61 млн клеток; 5 – 0,97 млн клеток; 6 – 12,8 млн клеток
Рис. 2 . Относительная эффективность пересадки изологичного (1), гомологичного (2) и гетерологичного (3) костного мозга.
Слайд 15
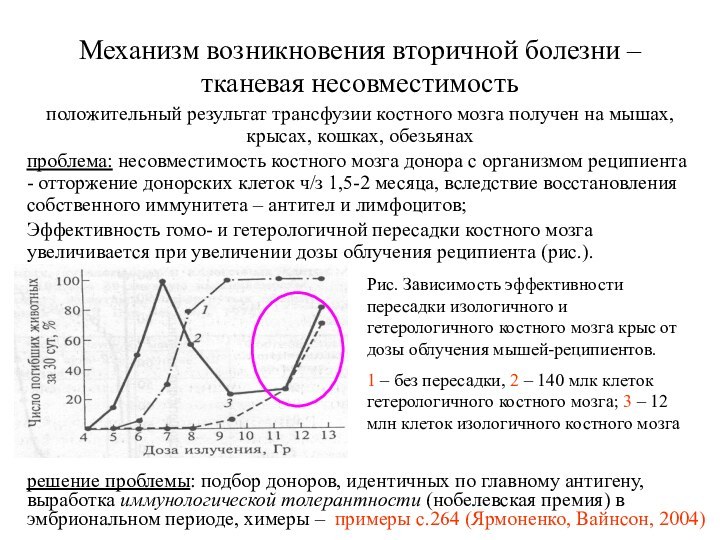
Механизм возникновения вторичной болезни – тканевая несовместимость
положительный результат
трансфузии костного мозга получен на мышах, крысах, кошках, обезьянах
проблема:
несовместимость костного мозга донора с организмом реципиента - отторжение донорских клеток ч/з 1,5-2 месяца, вследствие восстановления собственного иммунитета – антител и лимфоцитов;
Эффективность гомо- и гетерологичной пересадки костного мозга увеличивается при увеличении дозы облучения реципиента (рис.).
Рис. Зависимость эффективности пересадки изологичного и гетерологичного костного мозга крыс от дозы облучения мышей-реципиентов.
1 – без пересадки, 2 – 140 млк клеток гетерологичного костного мозга; 3 – 12 млн клеток изологичного костного мозга
решение проблемы: подбор доноров, идентичных по главному антигену, выработка иммунологической толерантности (нобелевская премия) в эмбриональном периоде, химеры – примеры с.264 (Ярмоненко, Вайнсон, 2004)
Слайд 16
Проблемы трансфузии костного мозга человеку
Проблема: Иммунитет ограничивает возможности
трансплантации костного мозга
Решение: разработка путей преодоления иммунологического барьера
Удаление максимального
числа иммунокомпетентных лимфоидных клеток донора
Подбор доноров на основе гистосовместимости
До сих пор нет абсолютно надежных методов
В 1970-е гг расшифрована генетическая система гистосовместимости человека, что создало возможность подбора доноров по главному антигену системы – появилась возможность гомологичных пересадок костного мозга после равномерного терапевтического гамма-облучения
Другие реально возможные методы:
Пересадка аутологичного костного мозга: интактного и из участков, подвергшихся облучению в небольших дозах (до 5 Гр) или экранированных
Адекватная поддерживающая терапия: восстановление кроветворения при облучении в дозах 10-12 Гр без трансплантации
Слайд 17
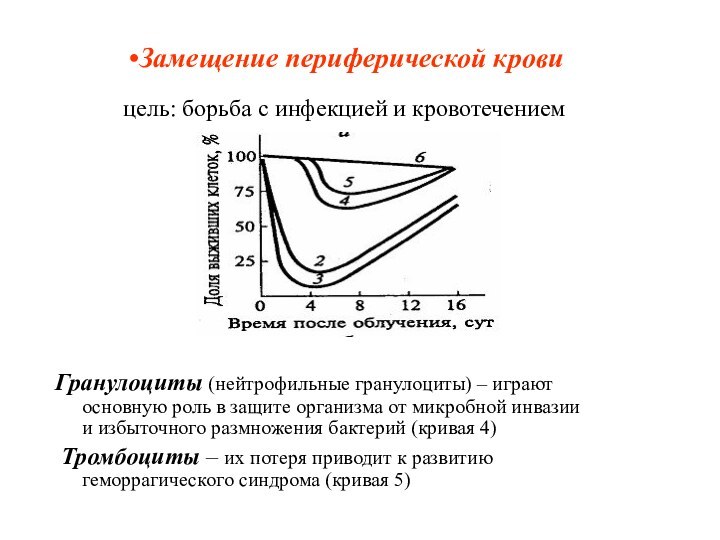
Замещение периферической крови
цель: борьба с инфекцией и
кровотечением
Гранулоциты (нейтрофильные гранулоциты) – играют основную роль в
защите организма от микробной инвазии и избыточного размножения бактерий (кривая 4)
Тромбоциты – их потеря приводит к развитию геморрагического синдрома (кривая 5)
Слайд 18
Замещение периферической крови
Методы:
введение гранулоцитов от интактных
животных (значительное повышение уровня устойчивости к инфекции не требует
поддержания высокого уровня лейкоцитов), проблема: короткое время жизни гранулоцитов – период обращения в крови человека 6-8 часов
введение тромбоцитов (эффективно переливание только свежих тромбоцитов),
введение эритроцитов (в случае кровопотери – лечение анемии);
Переливание жидкостей, солевых растворов, глюкозы (компенсация утраты воды и электролитов, сопутствующую поражению кишечника)
переливание цельной крови - применение клеточных концентратов более эффективно. Перед переливанием кровь облучают чтобы инактивировать иммунокомпетентные клетки (15-25 Гр)
Слайд 19
Цель: купировать функциональные расстройства
В борьбе с проявлением костно-мозгового
синдрома – это поддержание и улучшение деятельности всех органов
и систем организма, пораженных излучением до тех пор, пока не восстановится популяция стволовых кроветворных клеток
Успешное применение на человеке:
- применение антибиотиков (+антимикотических средств) с профилактической целью
применение антибиотиков одновременно с заместительной терапией
- Создание высокой концентрации антибиотиков не только в крови, но и в Ж/К тракте
На стадии исследования (эксперименты на животных)
-фармакохимические препараты для ранней терапии ОЛБ – модификаторы биологических реакций, иммуномодуляторы: вещества микробного происхождения, природные и синтетические полисахариды, цитокины
Хорошие результаты на животных показал Интерлейкин (ИЛ)
2.Функциональная терапия
Слайд 20
цитокины
Низкомолекулярные пептиды (мономеры аминокислот связанные пептидными мостами), которые
обнаруживаются в кровотоке и в тканях млекопитающих в норме
и служат для передачи межклеточной информации
Препараты цитокинов регулируют пролиферацию и дифференцировку гемопоэтических клеток-предшественниц – ускоряют процесс восстановления количества стволовых клеток;
Цитокины оказывают дифференцирующее влияние на кроветворные клетки, направляя их в сторону лейкопоэза;
Ц. Улучшают функцию зрелых гранулоцитов в кровотоке;
В целом Ц. уменьшают степень выраженности и продолжительность лейкопении
Появились данные об усилении эндогенной продукции цитокинов под действием лекарственных средств-модификаторов радиобиологических реакций – радиозащитных препаратов.
См журнал «Радиационная биология. Радиоэкология»
Слайд 21
Хроническая лучевая болезнь (ХЛБ) - форма лучевого поражения,
развивающаяся в результате продолжительного облучения в дозах, суммарно достигающих
1-3 Гр при интенсивности облучения 0,001-0,003 Гр/сут.
Сроки развития проявлений ХЛБ - от нескольких месяцев до нескольких лет.
Для ХЛБ, как и ОЛБ, характерен фазовый характер течения болезни
Своеобразие ХЛБ: - в активно пролиферирующих тканях, длительное время сохраняется восстановление тканей благодаря процессам клеточного обновления ;
- в стабильных системах (сердечно-сосудистой, эндокринной, нервной) наблюдается комплекс функциональных реакций и медленно нарастающие дистрофические изменения.
Слайд 22
Биологическое действие инкорпорированных радионуклидов
Пути поступления радионуклидов в организм
(1)
Через легкие (площадь дыхательных альвеол близка к 100 м2,
что в 50 раз больше поверхности кожи) ? в дальнейшем в зависимости от размера и свойств частиц возможно:
поступление в кровь и депонирование в органах,
поступление в кишечник и всасывание через кишечную стенку;
поглощение фагоцитами в альвеолах и выведение или миграция в лимфатические узлы – радиоактивные газы, аэрозоли (туман, дым, пыль) – при ингаляции короткоживущих и нетранспортабельных радионуклидов критическим органом становятся легкие
Слайд 23
Пути поступления радионуклидов в организм (2)
с водой и
пищей – естественные и искусственные радионуклиды – судьба поглощенных
радионуклидов зависит от их растворимости в жидкой среде кишечника.
Например: при щелочном рН кишечника многие трансурановые элементы (например Pu) превращаются в нерастворимые гидроксиды;
наоборот плохо растворимые в воде радионуклиды в ж-к тракте становятся растворимыми и легко всасываются в кровь. Большая доля радионуклидов выводится.
Критическим органом становится ж-к тракт, альфа- и бета-частицы облучают только стенки, а гамма-кванты – внутренние органы.
Слайд 24
Пути поступления радионуклидов в организм (3)
Через кожу –
плутоний, тритий, газообразный йод, фосфор, радон – поступают как
через поврежденные участки кожи, так и через неповрежденные – кровотоком разносятся по организму – эффективность аналогична эффективности поступления другими путями.
Проницаемость кожи увеличивается при повреждении рогового эпителия, обезжиривании и пр.
Последствия для кожи: повреждение стволовых клеток
(Стволовые пролиферирующие клетки расположены в коже на глубине 50-150 мкм)
и более глубоких слоев, ответственных за обмен веществ в эпидермисе
Слайд 25
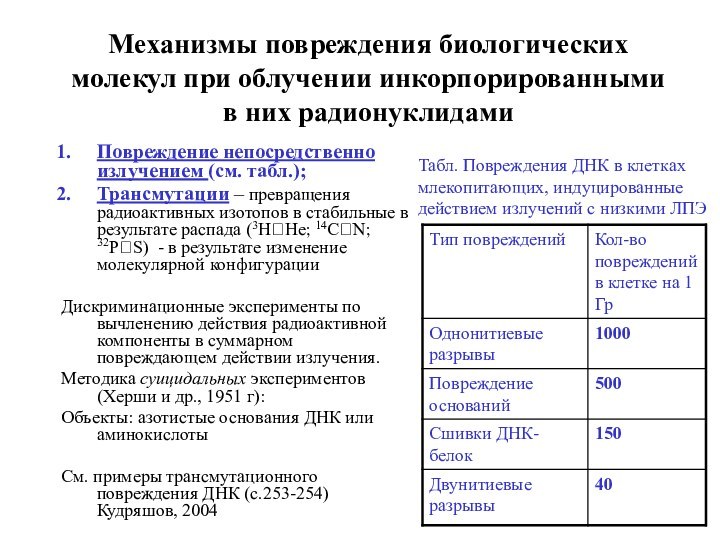
Механизмы повреждения биологических молекул при облучении инкорпорированными в
них радионуклидами
Повреждение непосредственно излучением (см. табл.);
Трансмутации – превращения
радиоактивных изотопов в стабильные в результате распада (3Н?He; 14C?N; 32P?S) - в результате изменение молекулярной конфигурации
Дискриминационные эксперименты по вычленению действия радиоактивной компоненты в суммарном повреждающем действии излучения.
Методика суицидальных экспериментов (Херши и др., 1951 г):
Объекты: азотистые основания ДНК или аминокислоты
См. примеры трансмутационного повреждения ДНК (с.253-254) Кудряшов, 2004
Табл. Повреждения ДНК в клетках млекопитающих, индуцированные действием излучений с низкими ЛПЭ
Слайд 26
Распределение инкорпорированных радионуклидов в организме
в минеральной части скелета
- элементы щелочноземельной группы (Ca - Sr, Ba, Ra),
Р-32, соединения Pu и Th – остеотропные РН; Am-241!!
В защитных клетках организма - соединительной ткани, компонентах крови, печени, капиллярах – редкоземельные элементы (Сe, Pr, Pm), Zn, Th и трансурановые элементы (Am, Pu etc.) – органотропные радионуклиды
Диффузный тип распределения – щелочные элементы (К-Cs, Na, Rb), также N, C, Po, H – диффузные радионуклиды
Слайд 27
Последствия местного облучения органов радионуклидами с избирательным распределением
При
длительном ингаляционном поступлении некоторых радионуклидов (Pu-239), и газов (Th-232,
Rn-222) или аппликации могут развиться рак бронхов или рак кожи.
При поступлении в организм радиофосфора – развивается анемия, радиойода – дисфункция щитовидной железы, радия – опухоль костной ткани.
Слайд 28
Примеры скоростей миграции радионуклидов в организме
Ca и Cr
переходят из крови в скелет через 4-10 ч;
Am(III) –
через 1-2 сут!
J – в щитовидную железу – через несколько минут и полный переход из крови заканчивается через 10-15 часов
U – выводится из крови ч/з 12 ч
В органах и тканях радионуклиды распределяются неравномерно, формируют «горячие пятна» - это влияет на дозу облучения
Слайд 29
Ранжирование органов по интенсивности накопления и выведения радионуклидов
По
накоплению: максимум – щитовидная железа (далее по мере убывания)
> печень > кишечник > почки > скелет > мышцы;
По скорости выведения: максимум – щитовидная железа (далее по мере убывания) > печень > почки > селезенка > кожа > мышцы > скелет
Слайд 30
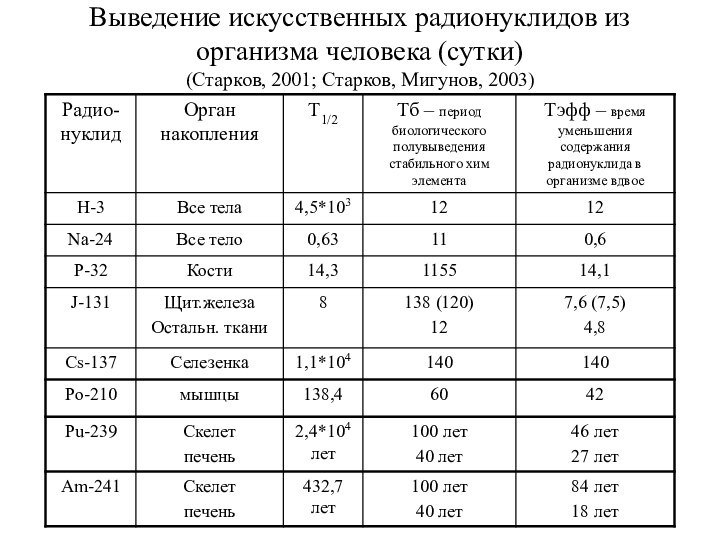
Выведение искусственных радионуклидов из организма человека (сутки)
(Старков, 2001;
Старков, Мигунов, 2003)
Слайд 31
Предотвращение и лечение поражений инкорпорированными радионуклидами
Цель: снижение всасывания
и ускорение выведения из организма
Методы:
Прием сорбентов
Промывание желудка
Прием солевых
слабительных растворов, применение клизм
Замена радионуклидов на стабильные изотопы: прием KJ – замена J-131,
Слайд 32
Эффекты ионизирующего излучения
Детерминированные пороговые эффекты – лучевая болезнь,
лучевой дерматит, лучевая катаракта, лучевое бесплодие, аномалии развития плода
и др.;
Для ранних детерминированных эффектов характерна зависимость от дозы облучения и дозовый порог
Стохастические беспороговые эффекты – злокачественные опухоли, лейкозы, наследственные болезни
Возникновение стохастических эффектов возможно при сколько угодно малой дозе облучения. Величина облучения влияет на вероятность возникновения эффекта (чем больше доза, тем выше вероятность)
Слайд 33
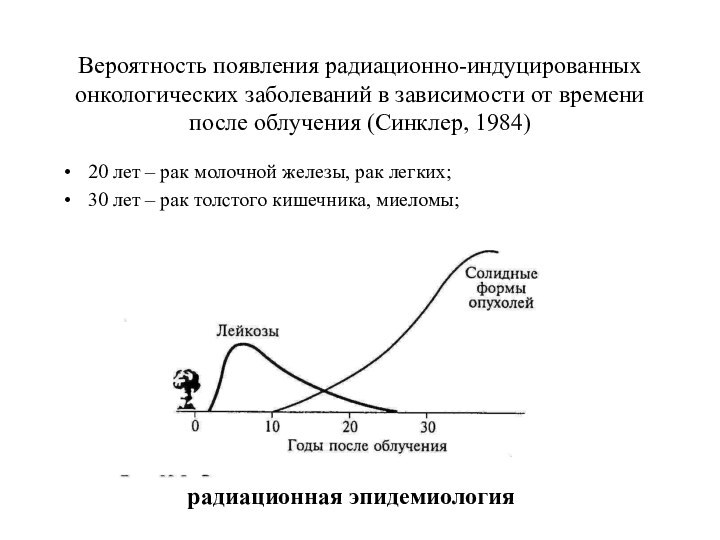
Вероятность появления радиационно-индуцированных онкологических заболеваний в зависимости от
времени после облучения (Синклер, 1984)
20 лет – рак молочной
железы, рак легких;
30 лет – рак толстого кишечника, миеломы;
радиационная эпидемиология
Слайд 34
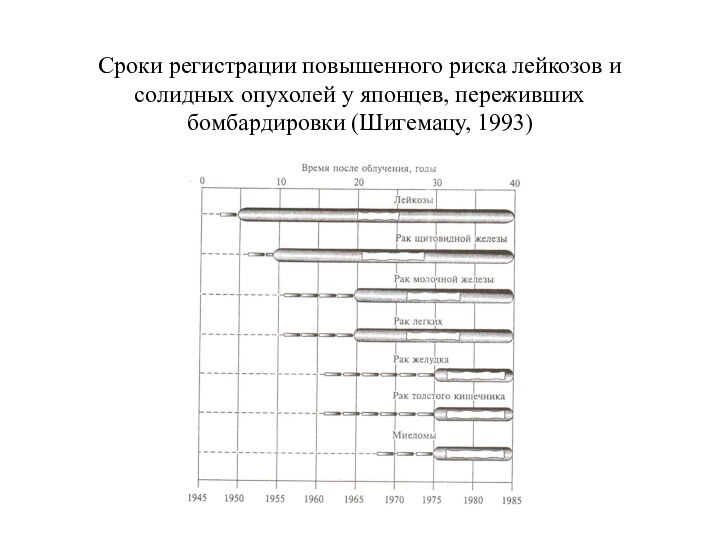
Сроки регистрации повышенного риска лейкозов и солидных опухолей
у японцев, переживших бомбардировки (Шигемацу, 1993)
Слайд 35
Рак ЩЖ
Редкое заболевание
Наиболее распространенная форма рака у детей,
До 10 лет ЩЖ – наиболее восприимчивый орган к
лучевому раку (действие радиойода), что обусловлено митотической активностью;
Наибольший риск – для 0-4 лет
Слайд 36
Опосредованные эффекты облучения на уровне организма
(при хроническом
облучении в малых дозах)
наблюдаются в органах и системах, не
подвергнутых непосредственному облучению
Эффект свидетеля – поражения органов системы кроветворения (см. предыдущие лекции)
Угнетение иммунитета – повышенная чувствительность к возбудителям инфекционных заболеваний, сопровождающихся изменением микрофлоры организма, в частности кишечника
клинические проявления: частые ОРЗ, пневмония, нефрит, уретрит
одна из причин: иммунная пассивность лимфоцитов
Нарушение обмена веществ –– нарушение белкового обмена, обмена углеводов, липидного обмена ингибирование окислительного фосфорилирования в клетках радиочувствительных органов; угнетения ферментативных реакций синтеза ДНК и пр.
Нервно-психические расстройства - искажение межнейронных и межсистемных связей
Проявления: расстройства поведения, сна, судорожные припадки. У потомства: депрессия интеллекта, аффективный синдром.
Слайд 37
Отдаленные последствия облучения
Соматические – следствие радиационных мутаций
в соматических клетках самих облученных объектов:
радиационная катаракта,
сокращение продолжительности жизни,
злокачественные
новообразования,
склероз различных органов
см. в Ярмоненко, Вайнсон, 2004
Генетические – наследственные заболевания, уродства и пороки развития потомства, возникающие вследствие радиационных мутации в зародышевых клетках облученных родителей
Слайд 38
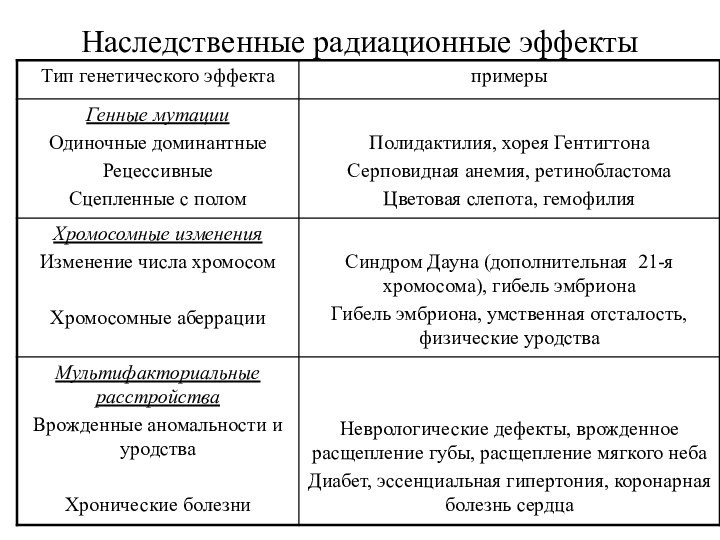
Наследственные радиационные эффекты
Слайд 39
Последствия облучения
эмбриона и плода
Радиочувствительность организма в период
внутриутробного развития очень высока. т.к. организм состоит из делящихся
и дифференцирующихся клеток
Радиочувствительность органов плода не определяется радиочувствительностью органов взрослого организма.
Пример: частым последствием облучения плода является микроцефалия (малая величина черепа и мозга при относительно нормальных размерах других частей тела) или отсутствие ЦНС при небольших дозах (0,5-2 Гр). У взрослого человека ЦНС – самая радиорезистентная система
Слайд 40
Пороки развития определяются радиочувствительностью конкретных систем на разных
стадиях развития в момент облучения. Фракционированное облучение приводит к
более тяжким повреждениям, чем однократное.
пример: мозжечок дифференцируется последним из всех отделов ЦНС и поэтому радиационное поражение мозжечка возможно только после рождения
Эмбриогенные эффекты являются в основном результатом прямого действия радиации, на опосредованное действие через организм матери приходится не более 5%.
Пример: облучение матери до зачатия в заведомо повреждающих дозах (до 4 Гр) не приводят к отклонениям развития плода;
Пример: отлучение эмбриона в небольших дозах (0,1-0,25 Гр) приводят к заметным отклонениям в развитии, но не влияют на мать
Слайд 41
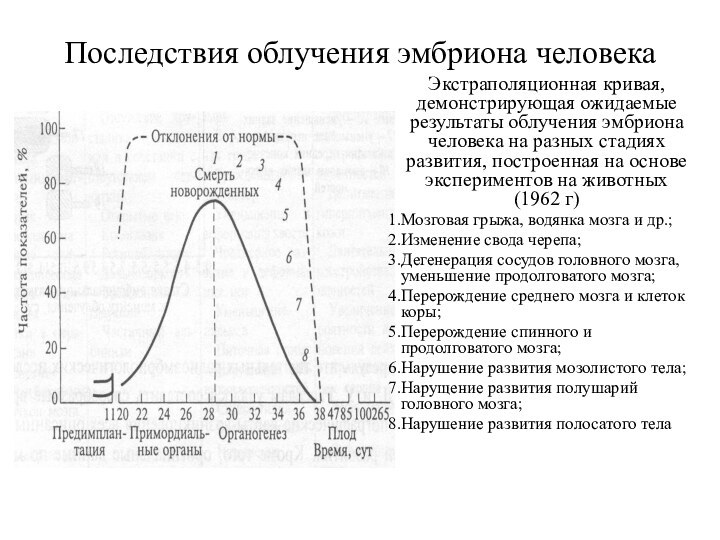
Последствия облучения эмбриона человека
Экстраполяционная кривая, демонстрирующая ожидаемые результаты
облучения эмбриона человека на разных стадиях развития, построенная на
основе экспериментов на животных (1962 г)
Мозговая грыжа, водянка мозга и др.;
Изменение свода черепа;
Дегенерация сосудов головного мозга, уменьшение продолговатого мозга;
Перерождение среднего мозга и клеток коры;
Перерождение спинного и продолговатого мозга;
Нарушение развития мозолистого тела;
Нарущение развития полушарий головного мозга;
Нарушение развития полосатого тела
Слайд 42
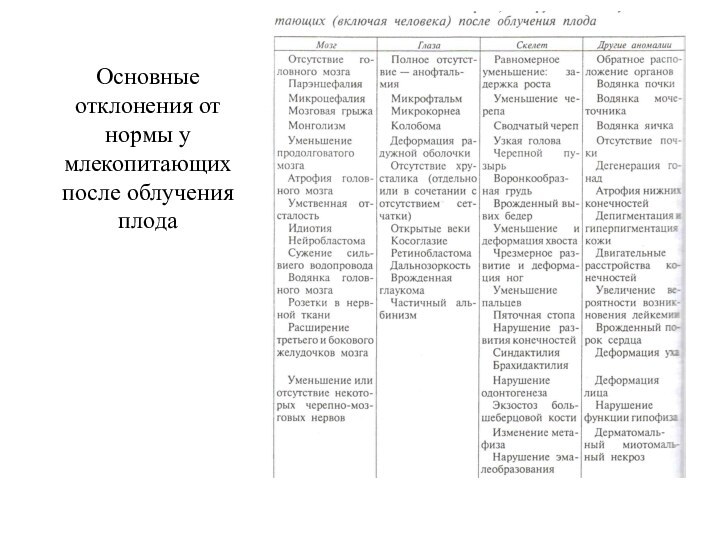
Основные отклонения от нормы у млекопитающих после облучения
плода
Слайд 43
Особенности радиационного поражения эмбриона и плода человека
Через 40
суток после зачатия грубые уродства вызвать трудно, после рождения
- невозможно
Облучение эмбриона человека в первые 2 месяца ведет к 100% поражению; в период с 3 по 5 месяц – к поражению на уровне 64%; в период от 6 до 9 месяцев к поражению в 23% случаев.
Исход поражения эмбриона зависит от соотношения процессов поражения и регенерации.
Пример: облучение в дозе 0,5 Гр может вызвать гибель большинства клеток сетчатки глаза эмбриона мыши, но они регенерируются и мышонок рождается зрячим
Пороговая доза излучения, вызывающая аномалию плода человека, пока не установлена.
Облучение эмбриона в малых дозах может не повлиять на развитие организма, но может вызвать отдаленные последствия.
Пример: частота лейкемий у потомства матерей, подвергшихся рентгеновскому облучению во время беременности, увеличивается в 1.5-2 раза.
(пример!) При дозе 0,01 Гр частота детского рака увеличивается на 40% над спонтанным уровнем.
Слайд 44
Дефекты нервной системы, выявляемые у детей с радиационных
территорий ЧАЭС и ПО «Маяк»
(Пивоваров, Михалев, 2004)