- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Анестезиологическое обеспечение в детской педиатрии. Классификация видов обезболивания
Содержание
- 2. Главной и основной целью анестезиологического обеспечения хирургических
- 3. Хирургическая агрессия, неизбежный побочный
- 5. Современное анестезиологическое пособие в зависимости
- 6. Меры интраоперационной профилактики реализации хирургической агрессии
- 7. Критерии адаптационной готовности новорожденного и детей грудного возраста к хирургической и анестезиологической агрессии
- 8. Понятно, что лабораторные показатели лишь косвенно
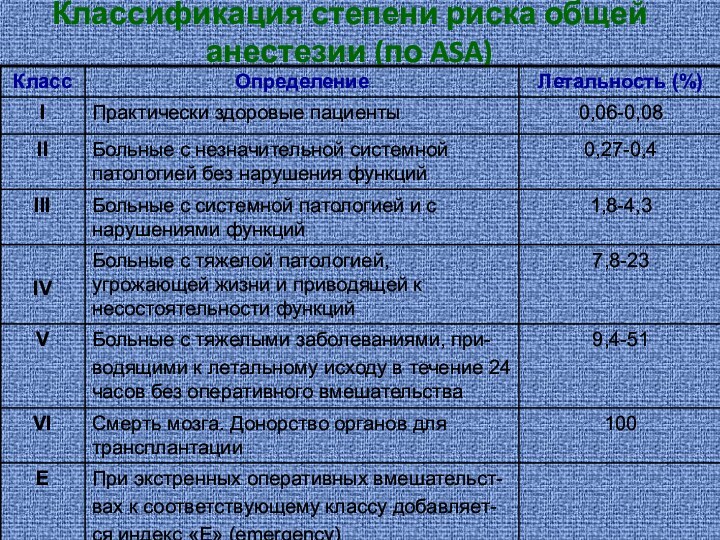
- 9. Классификация степени риска общей анестезии (по ASA)
- 10. Как видно, практически все новорожденные и
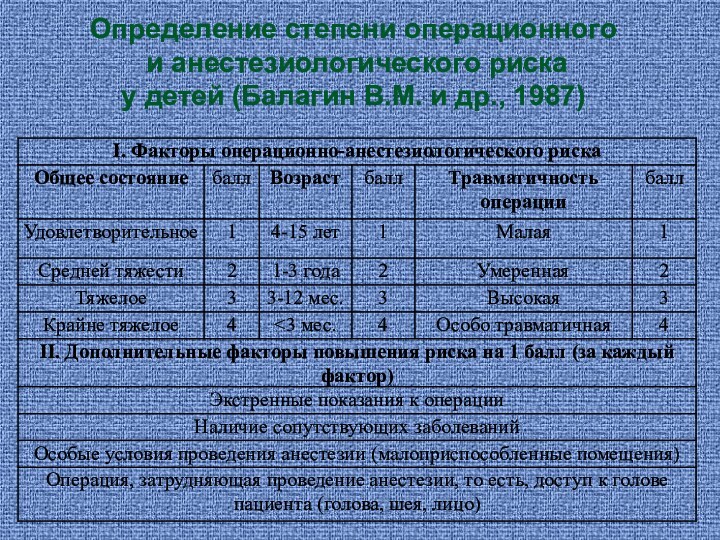
- 11. Определение степени операционного и анестезиологического риска у детей (Балагин В.М. и др., 1987)
- 12. Определение степени операционного и анестезиологического риска у детей (Балагин В.М. и др., 1987)
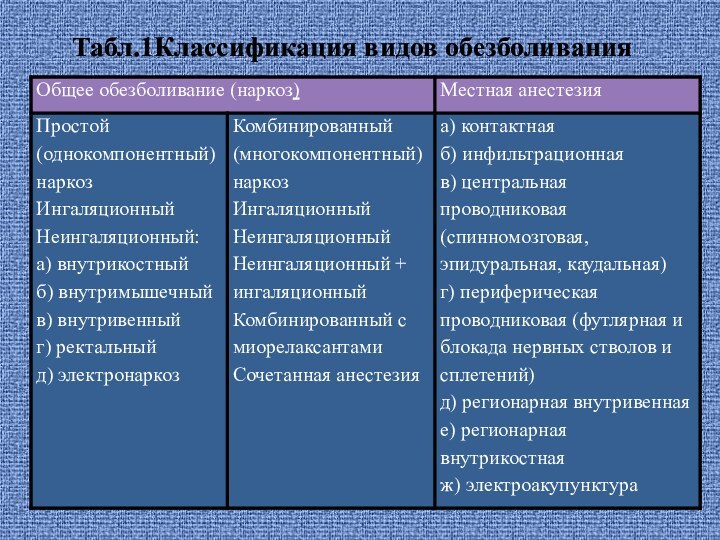
- 13. Табл.1Классификация видов обезболивания
- 14. При выборе метода анестезии приходится исходить из
- 15. Особенности гомеостаза, влияющие на анестезиологическое обеспечение новорожденных и грудных детей (1)
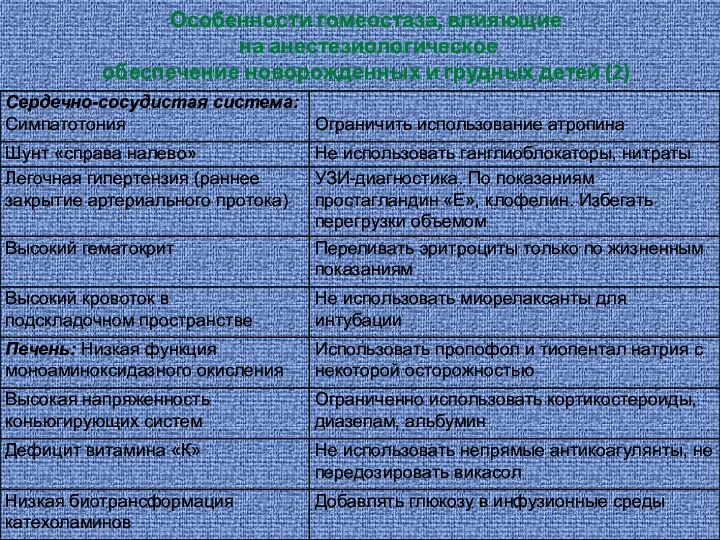
- 16. Особенности гомеостаза, влияющие на анестезиологическое обеспечение новорожденных и грудных детей (2)
- 17. Особенности гомеостаза, влияющие на анестезиологическое обеспечение новорожденных и грудных детей (3)
- 18. Современная модель точек приложения механизма анестезии
- 19. Различают: I стадию - анальгезию; II стадию
- 20. Комбинированный ингаляционный и внутривенный наркоз у новорожденных
- 21. На 5-6 минуте от начала анестезии внутривенно
- 22. В качестве гипнотиков у новорожденных и грудных
- 23. Быстрое введение таких доз вызывает брадикардию, брадиаритмии,
- 24. Малые по продолжительности операции, манипуляции выполняются
- 25. Схема 2. Методика: в мышцу вводится
- 26. Схема 3. 1. Промедол 0,5 мг/кг
- 27. Варианты атаралгезии Схема 4. 1.
- 28. При операциях на головном мозге, лицевом скелете
- 29. Схема 5. Премедикация: атропин 0,02 мг/кг в/м.
- 30. Атропин в премедикации новорожденных и
- 31. Отношение к нейроаксиальным методам обезболивания новорожденных и
- 32. Сепсис, локальные инфекции кожи, коагулопатии, спинальные деформации,
- 33. ИВЛ во время операции должна соответствовать следующим
- 34. Скачать презентацию
- 35. Похожие презентации
Главной и основной целью анестезиологического обеспечения хирургических вмешательств является адекватная защита организма ребенка от операционного стресса.





























Слайд 2 Главной и основной целью анестезиологического обеспечения хирургических вмешательств
является адекватная защита организма ребенка от операционного стресса.
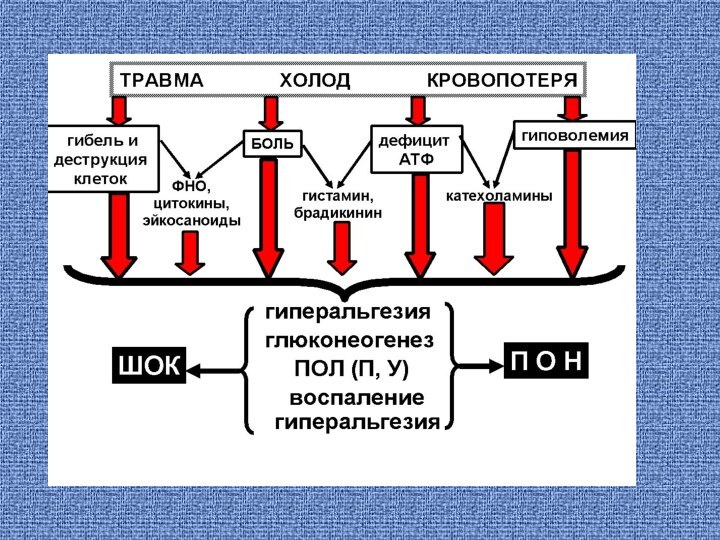
Слайд 3 Хирургическая агрессия, неизбежный побочный эффект
хирургического лечения, особенно у новорожденных и детей грудного возраста
понимается как комплекс факторов (стрессоров), запускающих неспецифическую генерализованную защитную реакцию пациента, направленную на адаптацию к продолжающемуся действию стрессоров. Первичные хирургические стрессоры: травма, холод, кровопотеря. Посредством боли, деструкции клеток, повышения расхода энергии, снижения объема циркулирующей крови они инициируют выброс медиаторов боли (гиперальгезии), воспаления, термогенеза, глюконеогенеза.Слайд 5 Современное анестезиологическое пособие в зависимости от
исходного состояния пациента и характера операции включает в себя
следующие компоненты:1. Торможение психического восприятия или выключение сознания.
2. Обеспечение центральной или периферической анальгезии (устранение боли).
3. Нейровегетативная блокада.
4. Миорелаксация.
5. Поддержание адекватного газообмена.
6. Обеспечение адекватного кровообращения.
7. Поддержание адекватного метаболизма .
Слайд 7
Критерии адаптационной готовности
новорожденного и детей грудного возраста
к хирургической и анестезиологической агрессии
Слайд 8 Понятно, что лабораторные показатели лишь косвенно отражают
способность пациента перенести хирургическую и химическую травму без ущерба
для адаптационных систем. Поэтому все существующие способы оценки операционного и анестезиологического риска основаны на не вполне точных, но, зато, интегральных тестах (общее состояние, возраст, характер операции и т. д.). Эти тесты сведены в шкалы оценки риска анестезии, из которых наиболее распространена классификация Американского Общества Анестезиологов (АОА), (часто используется аббревиатура «ASA»).Слайд 10 Как видно, практически все новорожденные и дети
грудного возраста с хирургической патологией относятся к III- V
классу (или могут быть искусственно отнесены в эти классы). Классификация ASA больше пригодна для плановой хирургии взрослых. В отношении новорожденных и грудных детей наиболее логичной система, предложенная В.М. Балагиным В.М. (1987) и отраженная в таблице. По этой методике пациенты также распределяются по пяти классам, но вероятность субъективизма оценки резко снижается.
Слайд 11
Определение степени операционного
и анестезиологического риска
у детей
(Балагин В.М. и др., 1987)
Слайд 12 Определение степени операционного и анестезиологического риска у детей
(Балагин В.М. и др., 1987)
Слайд 14 При выборе метода анестезии приходится исходить из особенностей:
метаболизма новорожденных и грудных детей, обусловленных напряжением энергетических резервов,
предрасположенностью к централизации кровообращения, высокой нагрузкой на детоксицирующие системы даже в физиологических условиях. Специфические для новорожденных особенности гомеостаза, важные для выбора метода анестезии и обеспечения ее безопасности.
Слайд 15
Особенности гомеостаза, влияющие
на анестезиологическое
обеспечение новорожденных и
грудных детей (1)
Слайд 16 Особенности гомеостаза, влияющие на анестезиологическое обеспечение новорожденных и
грудных детей (2)
Слайд 17 Особенности гомеостаза, влияющие на анестезиологическое обеспечение новорожденных и
грудных детей (3)
Слайд 18 Современная модель точек приложения механизма анестезии основана
на представлении о пресинаптическом угнетении кальциевых и активации калиевых
каналов как причине анальгезии. Седацию и амнезию, по этой модели, вызывает активация постсинаптических «ГАМК»-рецепторов. Угнетение глютамат-рецепторов, реализуемое кетамином, является альтернативным путем. Местные анестетики блокируют кальциевые и натриевые каналы.
Слайд 19
Различают:
I стадию - анальгезию;
II стадию -
возбуждение;
III стадию - хирургическую, которая делится по глубине
на три уровня: III1, Ш2, Ш3;IV стадию - пробуждение.
Слайд 20 Комбинированный ингаляционный и внутривенный наркоз у новорожденных и
детей грудного возраста
Схема 1. Премедикация: диазепам 0,3мг/кг,
атропин 0,01мг/кг в/м за 30 минут до подачи больного в операционную. Контур наркозного аппарата заполняется севораном по рекомендуемой методике до подключения его к пациенту (севоран включается на 8 объемных процентов при газотоке 8 л/мин, дыхательный мешок заполняется три раза). Индукция наркоза: севоран первые 2 минуты в дозе 6-8 об/% с газотоком 8 л/мин 100% кислородом. После установления периферического катетера доза севорана снижается до 2,5-3 об/%, а газоток - до 1-2 л/мин (далее эти компоненты как правило постоянны на протяжении всей операции).
Слайд 21 На 5-6 минуте от начала анестезии внутривенно вводится
пропофол в дозе 1-1,5мг/кг, на фоне развивающегося апноэ выполняется
интубация трахеи или установка ларингеальной маски. Перевод на ИВЛ с основными параметрами: дыхательный объём 4-6 мл/кг, соотношение вдоха к выдоху 1:2, давление на вдохе 10-12-15 см вод.ст, FiO2 - 0,5, не исключается возможность спонтанного дыхания, особенно в конце операции. Использование миорелаксации у детей первых месяцев жизни в послеоперационном периоде вызывает некоторую нежелательную миотонию. Анальгезия: фентанил 2,5-3,5мкг/кг/ч на фоне подачи севорана до 2,5-3 об/%. Использование севорана до 2-2,5 об/%, в сочетании с пропофолом 1,5-2 мг/кг/ч позволяет отказаться от релаксантов, а дозу фентанила снизить до 2 мкг/кг/ч, что обеспечивает быстрое пробуждение пациента без опасности депрессии дыхания в послеоперационном периоде.Слайд 22 В качестве гипнотиков у новорожденных и грудных детей
широко применяются мидазолам и оксибутират натрия (оксибат).
Мидазолам выгодно отличается от диазепама хорошей растворимостью в воде, отсутствием стабилизатора (бензоевой кислоты). Время полувыведения мидазолама в периоде новорожденности 8 часов, диазепама – 32 часа. После моноаминоксидазного окисления в печени вторичный метаболит мидазолама нетоксичен и неактивен, вторичный метаболит диазепама (дизметилдиазепам) активен не менее чем предшественник. Оксибутират – единственный медикамент с прямым действием на гипофиз. Высокие дозы, применяемые для введения в наркоз (100-150мг/кг), вызывают седацию и миорелаксацию, снижение основного обмена.
Слайд 23 Быстрое введение таких доз вызывает брадикардию, брадиаритмии, рвоту,
поэтому рекомендуется вводить дозу оксибутирата шприцевым дозатором, время болюса
5 мин.С позиции влияния на мозговой кровоток, препаратами выбора среди анальгетиков являются опиаты, не изменяющие кровенаполнение и интенсивность метаболизма головного мозга. Предпочтение промедолу, поскольку он не обладает кардиодепрессивным эффектом и не провоцирует спазмы гладкой мускулатуры и парез кишечника, как морфин, а также не вызывает бронхоспазм, подобно фентанилу.
Слайд 24 Малые по продолжительности операции, манипуляции выполняются под
кетаминовым наркозом.
В периоде новорожденности существует относительный дефицит магния,
что способствует избыточной активности NMDA-рецепторов, поэтому применение кетамина, блокирующего именно этот компонент боли, обосновано. Следует иметь в виду, что обычные (2-2,5 мг/кг) дозы кетамина у новорожденных могут угнетать ритм дыхания. Известно, что карбоксильные группы кетамина, блокируя моноаминоксидазу, усиливают и пролонгируют эффекты катехоламинов. Поэтому, во избежание истощения симпатической системы, рекомендуется перед введением кетамина ввести унитиол 5 мг/кг в/м как донатор сульфгидрильных групп. Слайд 25 Схема 2. Методика: в мышцу вводится унитиол
5% - 5 мг/кг, через 3-5
минут в мышцу или в вену мидазолам 0,5 мг/кг, через 3 минуты после введения мидазолама вводится кетамин 5 мг/кг в мышцу или 2 мг/кг в вену.Описанная методика позволяет пролонгировать общую анестезию до 25-50 минут, снижает риск апноэ и уменьшает постнаркозные реакции.
Слайд 26
Схема 3.
1. Промедол 0,5 мг/кг в
мышцу (время ожидания 2 мин).
2. Катетеризация центральной или периферической
вены. Промедол 1-1, 5мг/кг в вену (болюс). 3. Местная анестезия 10% лидоканом голосовых складок. Интубация трахеи. ИВЛ.
4. Поддерживающая инфузия промедола в темпе
2 мг/кг/ч на первом часу операции, затем - 1-1,5 мг/кг/ч.
Обеспечивает хорошую анальгезию, глубокий наркоз и достаточную нейровегетативную защиту центральная анальгезия в виде мононаркоза промедолом, разработанная академиком В.А. Михельсоном.
Слайд 27
Варианты атаралгезии
Схема 4. 1. Атропин
0,02 мг/кг в/м.
2. Мидазолам 0,3-0,5 мг/кг в мышцу или
в вену. (Повторить через 40-60 минут в половинной дозе при длительной операции).3. Местная анестезия 10% лидокаином голосовых складок. Интубация трахеи. ИВЛ.
4.Фентанил 10 мкг/кг в вену струйно.
5.Поддерживающая инфузия фентанила 6-8 мкг/кг/час.
В этой схеме может использоваться даларгин, применение которого позволяет уменьшить расход фентанила, снизить общее периферическое сосудистое сопротивление. Даларгин в дозе 0,05-0,2 мкг/кг вводится в мышцу или под кожу за 5-10 минут до введения фентанила. Поддерживающая инфузия даларгина 0,2 мкг/кг/ч. При этом дозы фентанила: 6-8 мкг/кг болюс и 3 мкг/кг/ч поддерживающая инфузия.
Слайд 28 При операциях на головном мозге, лицевом скелете усиливает
анальгезию и снижает интенсивность кровопотери добавление клофелина (1,5 мкг/кг
в мышцу за 30 минут до операции однократно или с последующей поддерживающей инфузией 0,2-0,4 мкг/кг/ч).
Слайд 29
Схема 5.
Премедикация: атропин 0,02 мг/кг в/м.
Вводный
наркоз: натрия оксибутират (ГОМК) 100-150 мг/кг «плавно», но не
более 6 мин.Анальгезия: Фентанил 25-30 мкг/кг (доза вводится в три приема). Поддерживающая анальгезия: фентанил 10 мкг/кг/ч. Как альтернативу оксибутирату можно использовать диазепам, но бензодиазепин может «симулировать» некоторые эффекты ГОМК (седацию, миорелаксацию), не заменяя главного - стимуляцию гипофиза с основным эффектом в виде снижения энергетической затратности углеводного обмена. Вероятно, ГОМК – необходимый компонент при использовании высоких доз фентанила.