- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Отчет о проведений валидации
Содержание
- 2. Отчет о проведении валидации - Документ
- 3. Отчет о проведении валидации включает в себя
- 4. 5. Сведения о калибровке/поверке: 5.1. Средств измерений
- 6. Валидация аналитических методикВалидация аналитической методики – это
- 7. При валидации проводится оценка аналитической методики по
- 8. Скачать презентацию
- 9. Похожие презентации
Отчет о проведении валидации - Документ предприятия, отражающий и оценивающий результаты валидации процессов (PV) и всех стадий квалификации (DQ, IQ, OQ, PQ).




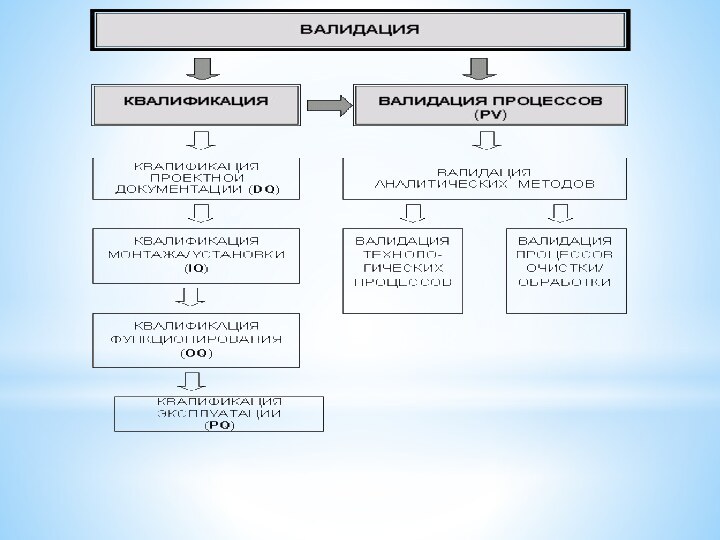


Слайд 3 Отчет о проведении валидации включает в себя следующие
положения, информацию, документы:
1. Объект валидации и его идентификация,
дата (период) и место проведения. 2. Цель и вид валидации.
3. Идентификация валидаторов (ФИО, должность, подпись, дата);
4. Исходная информация:
4.1. Общая характеристика объекта, включая критические параметры.
4.2. Перечень документации (регламенты, фармстатьи, проектная документации, инструкции, спецификации, сертификаты, паспорта и др.).
4.3. Перечень методик проведения испытаний (измерений, отбора проб и др.) и критериев оценки результатов.
4.4. Сведения о привлеченных организациях или экспертах.
Слайд 4
5. Сведения о калибровке/поверке:
5.1. Средств измерений (приборы,
датчики, весы и др.), установленных в оборудовании, инженерных системах,
помещениях и др.5.2. Средств измерений, используемых при проведении валидации/ квалификации.
6. Документы:
6.1. Валидационные протоколы всех стадий квалификации (DQ,IQ,OQ,PQ) и валидации процессов (PV), или ссылка на них с указанием места хранения.
6.2. Протоколы (отчеты и др.) с данными и результатами испытаний, отбора проб и т.п.
7. Анализ полученных результатов, в т.ч. по:
7.1. Проверке критических условий и параметров.
7.2. Выявленным отклонениям (изменениям), требующим действий по корректировке.
7.3. Условиям охраны труда и технике безопасности.
8. Вывод по результатам валидации.
9. Сроки проведения повторной плановой валидации.
Слайд 6
Валидация аналитических методик
Валидация аналитической методики – это экспериментальное
доказательство того, что методика пригодна для решения предполагаемых задач.
Настоящая
общая фармакопейная статья регламентирует характеристики аналитических методик, определяемые с целью их валидации, и соответствующие критерии пригодности валидируемых методик, предназначенных для контроля качества лекарственных средств: фармацевтических субстанций и лекарственных препаратов.Валидации подлежат методики количественного определения, в том числе методики определения примесей и методики определения предела содержания. Методики проверки подлинности подвергаются валидации при необходимости подтвердить их специфичность.
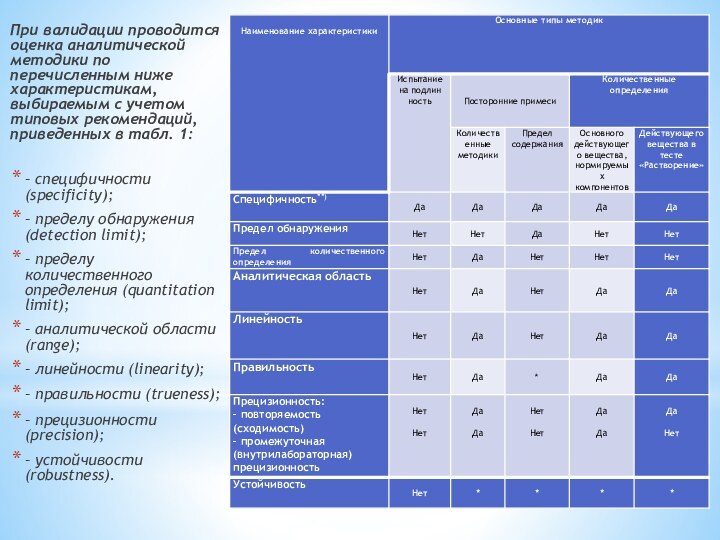
Слайд 7 При валидации проводится оценка аналитической методики по перечисленным
ниже характеристикам, выбираемым с учетом типовых рекомендаций, приведенных в
табл. 1:– специфичности (specificity);
– пределу обнаружения (detection limit);
– пределу количественного определения (quantitation limit);
– аналитической области (range);
– линейности (linearity);
– правильности (trueness);
– прецизионности (precision);
– устойчивости (robustness).





























